ЦИАНОУГЛЕРОДЫ, орг. соед., в к-рых
все или почти все атомы Н углеродной цепи замещены на группы CN. Ц. относятся
к полицианосоединениям. Накопление в молекуле высокополярных и не создающих
пространств. затруднений цианогрупп придает соед. необычные физ. и хим.
св-ва.
Большинство Ц.- высококипящие жидкости
или кристаллич. в-ва, т-ры кипения и плавления к-рых возрастают при последоват.
введении цианогрупп в молекулу (табл.). СН-Кислоты, содержащие неск. цианогрупп,
по силе сравнимы с минер. к-тами, напр. для пентациано-1,3-циклопентадиена
рКа-11
(вода, 25 °С); для сравнения рКадля НВr -9, для HI —11.
Хим. св-ва Ц. определяются способностью
цианогрупп активировать др. заместители и сопряженные кратные связи. Напр.,
Ц. легко присоединяют галогены по кратной связи в присут. галогенид-ионов;
при этом галогены ведут себя как нуклеофилы, а не электрофилы, что связано
с сильными электроноакцепторными св-вами группы CN, напр.:
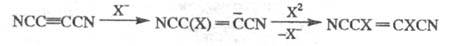
Ц. относятся к числу наиб. активных диенофилов
в р-циях циклоприсоединения (см. Тетрацианоэтилен).
Для Ц. характерно
замещение цианогрупп на группы ОН, OR, NH2 и др., напр. гексацианобензол
при обработке водой легко превращается в пентацианофенол (выход 95%).
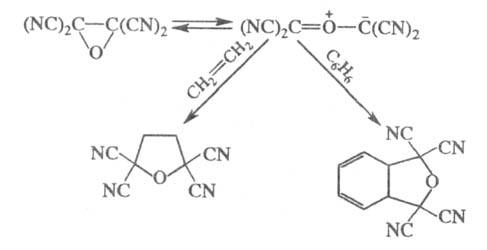
Тетрацианоэтиленоксид (образуется действием
Н2О2 на тетрацианоэтилен) присоединяется к олефинам
и даже аренам с разрывом связи С — С оксиранового кольца:
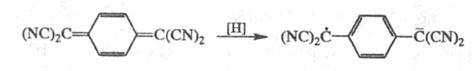
Благодаря суммарному электроноакцепторному действию цианогрупп Ц. проявляют высокое сродство к электрону и легко восстанавливаются с образованием устойчивых анион-радикалов, напр.:
С донорами p-электронов
Ц. образуют комплексы с переносом заряда (см. Тетрацианохинодиметан),
нек-рые
из них обладают металлич. проводимостью (см. Металлы органические).
Для получения Ц. используют общие методы
введения цианогруппы в молекулу (см. Нитрилы), а также специфич.
методы.
СВОЙСТВА НЕКОТОРЫХ ЦИАНОУГЛЕРОДОВ
|
Соединение
|
Мол. м.
|
Т. пл., °С
|
Т. кип., °С
|
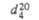 |
|
Дициан NCCN
|
52,04
|
-27,9
|
-21,2
|
—
|
|
Дицианоацетилен
NCC
 CCN CCN |
76,057
|
20,5-21
|
76-76,5
|
1,017
|
|
Дицианодиацетилен
(NCC
 С)2 С)2 |
100,079
|
64,5-65,5
|
154
|
—
|
|
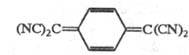
Тетради аноэтилен
(NC)2C=C(CN)2
|
128,09
|
201-202
|
223
|
1,318
|
|
Тетрацианохинодиметан
|
204
|
296-298
|
—
|
—
|
|
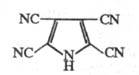
Тетрацианопиррол
|
167,13
|
203-212 (с разл.)
|
—
|
—
|
|
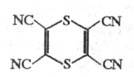
Тетрацишо- 1
,4-дитаин
|
184,24
|
207-208 (с разл.)
|
—
|
—
|
Трицианометан (в своб. виде и в виде солей) получают из производных малононитрила (р-ция 1); гексацианоэтан - из тетрацианоэтилена (2); дицианоацетилен - обработкой диамида ацетилендикарбоновой к-ты Р2О5 (3);
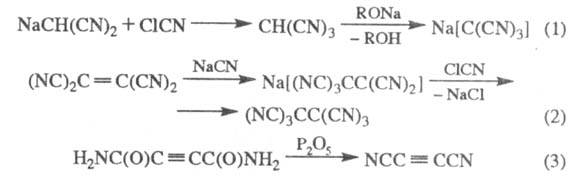
Окисление Na-соли димеркаптомалеинодинитрила приводит к тетрациано-1,4-дитиину, из к-рого получают полициа-ногетероциклы, напр.:
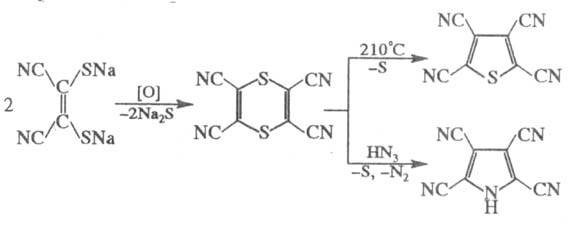
Ц.- полупродукты в орг. синтезе, нек-рые
из них представляют интерес как перспективные красители. Комплексы Ц. с
переносом заряда используют в электронной пром-сти в качестве полупроводников.
Многие Ц. могут отщеплять синильную к-ту,
поэтому обращаться с ними надо с осторожностью.
Лит.: Зильберман Е. Н., Реакции нитрилов, М., 1972; Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 677-92; The Chemistry of cyanogroup, ch. 9, N. Y., 1970, p. 423-638; Gmelin's Handbuch der anorganiscben Chenrie, 8 Aufl., Bd 14, 1976, S. 107-15; Kirk-Othmer encyclopedia, 3 ed., v. 6, N. Y., 1978, p. 625-33.
С. К. Смирнов.