1,3,5-ЦИКЛОГЕПТАТРИЕН
(тропилиден; ф-ла I), мол. м. 91,13; бесцв. жидкость, т. пл. -78,45 °С,
т. кип. 115,5 °С,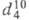 0,9105,
0,9105,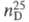 1,5208. Ц.
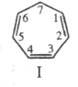
представляет собой смесь неплоских конформеров, находящихся гл. обр. в форме
ванны.
1,5208. Ц.
представляет собой смесь неплоских конформеров, находящихся гл. обр. в форме
ванны.
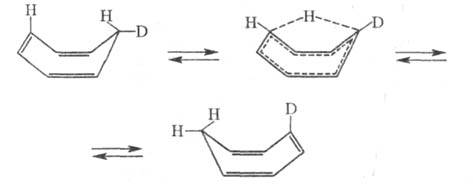
При 100-140 °С Ц. претерпевает изомеризацию, сопровождающуюся 1,5-трансаннулярным перемещением водорода:
Ц. проявляет св-ва ненасыщ. соед.: он неустойчив,
на воздухе легко окисляется и полимеризуется, бромируется. В двухфазной
водно-орг. среде в присут.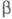 -циклодекстрина
в качестве межфазного катализатора и аниона гидридопентацианокобальтата
гидрируется до циклогептена. Окисление КМnО4 и водно-спиртовой
щелочью приводит к трополону (см. Трополоны), окисление Н2Сr2О7
- к бензальдегиду.
-циклодекстрина
в качестве межфазного катализатора и аниона гидридопентацианокобальтата
гидрируется до циклогептена. Окисление КМnО4 и водно-спиртовой
щелочью приводит к трополону (см. Трополоны), окисление Н2Сr2О7
- к бензальдегиду.
Ц. вступает в р-ции циклоприсоединения
(возможно 1,2-, 1,4- и 1,6-присоединение), в частности в р-цию диенового
синтеза с разл. ненасыщенными орг., фосфорорг. и сераорг. соед. Адцукт
Ц. с малеиновым ангидридом (т. пл. 104-105 °С) применяют для идентификации
Ц.
Ц. легко отщепляет гидрид-ион с образованием
иона тропилия (см. Тропилия соединения), при взаимод. с бензолом
в присут. Pd(OCOCH3)2 дает 1-фенил-1,3,5-циклогептатриен,
при взаимод. с ароматич. диазосоед. - 7-арилпроизводное. В жидком SO2
Ц. превращается в PhCH2SO2H.
Ц. образует комплексы со мн. переходными
металлами, координируясь в зависимости от природы металла и др. лигандов
по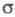 - и
- и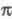 -типам.
Комплексы (
-типам.
Комплексы (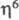 -C7H8)2M,
получающиеся при конденсации паров металлов с Ц., легко изомеризуются в
(
-C7H8)2M,
получающиеся при конденсации паров металлов с Ц., легко изомеризуются в
(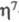 -С7Н7)(
-С7Н7)(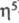 -С7Н9)М,
где М = Мо, Сr и др.
-С7Н9)М,
где М = Мо, Сr и др.
Получают Ц. циклоприсоединением карбенов,
генерированных из диазометана, к бензолу в присут. комплексов Сu или Rh.
Ц. образуется также при пиролизе 7,7-дихлорноркарана при 550 °С и давлении
16 кПа; из бициклич. углеводорода, получаемого из ацетилена и циклопентадиена:
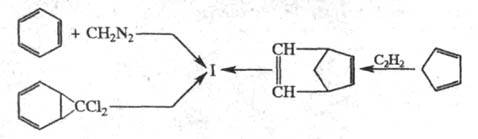
Ц. впервые получен А. Ладенбургом в 1881. Строение установили Р. Вильштеттер и Ф. Тиле в 1901.
Лит.: ВольпинМ.Е., "Успехи химии", 1960, т. 29, в. 3, с. 298-363; Джемилев У. М. [и др.], "Изв. АН СССР. Сер. хим.", 1991, № 5, с. 1063-69; Mach К. [а.о.], "Tetrahedron", 1984, v. 40, № 17, p. 3295-3303; Као J., "J. Amer. Chem. Soc.", 1987, v. 109, № 13, p. 3818-29; Saltо К, "J. Organomet Chem.", 1988, v. 338, № 2, p. 265-68; Green J. С. [а. о.], "J. Chem. Soc.", 1991, № 2, p. 173-180.
Г.Д. Коломникова.


