ШТАУДИНГЕРА РЕАКЦИИ, 1) синтез иминов взаимод. карбонильных соед. с иминофосфоранами (иминирование);
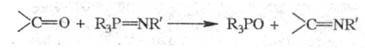
В р-цию вступают альдегиды, кетоны, изоцианаты, кегены, СО2 и др., напр.:
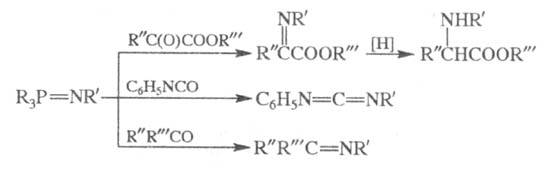
В качестве иминофосфоранов обычно используют
соед. с R, R'=Alk, Ar. При взаимод. R3P = NNH2 с
кетонами образуются гидразоны; ароматич. альдегиды и иминофосфораны типа
Аr3Р = NN = РАr3 дают азины АrСН = NN = СНАr.
Наряду с иминотриорганилфосфоранами в
р-цию вступают иминофосфораны общей ф-лы X3P = NR (X = OR, Hal)
и фосфазины R3P = NN = CR2.
Наиб. легко в Ш. р. вступают карбонильные
соед. с кумулир. двойными связями (изоцианаты, кетены); альдегиды и кетоны
вступают в р-цию лишь в жестких условиях (напр., смесь бензофенона и PhN
= PPh3 выдерживают 40 ч при 150 °С).
Ш. р. обычно проводят в орг. р-рителе
(напр., ТГФ, бензоле, диэтиловом эфире) или в его отсутствие. Смесь выдерживают
при комнатной т-ре или нагревают в течение неск. часов или суток. Выходы
обычно высокие.
Считают, что Ш. р. осуществляется с образованием
на промежут. стадии бетаина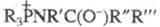 или четырехчленного циклич. аддукта ф-лы I. Такой механизм во многом аналогичен
механизму Виттига реакции.
или четырехчленного циклич. аддукта ф-лы I. Такой механизм во многом аналогичен
механизму Виттига реакции.
В условиях Ш.р. с иминофосфоранами реагируют
также тиокарбоиильные соед. (напр., тиокетоны, CS2, изотиоцианаты)
и SO2 .
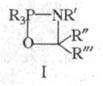
В р-цию, подобную Ш. р., вступают анионы амидофосфатов:
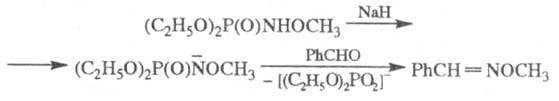
Ш. р. используют в лаб. практике, в т. ч. для синтеза аминокислот [восстановлением RC( = NR')COOR]. Открыта Г. Штаудингером и И. Мейером в 1919.
Лит.: Фосфазосоединения, К., 1965, с. 204-07; Trippett S., "Quart. Rev.", 1963, v. 17, № 3, p. 406-40; Appel P., Siegemund G., "Z. anorg. allg. Chem.", 1968, Bd 363, S. 183-90.
2) Получение иминофосфоранов действием азидов на третичные фосфины:
R3P + R'N3 R3P = NR' + N2
R3P = NR' + N2
R = Alk, AT; R' = H, Alk, Ar, Ac, глюкозил
и др.
Алифатич. азиды менее активны, чем ароматич.
и ацилазиды; в целом скорость р-ции возрастает с увеличением электроотрицательности
R'. В арилазидах электронодонорные заместители в
пара-положении
замедляют, а электроноакцепторные - ускоряют р-цию [напр., п-(СН3)2С6Н4К3
реагирует с Ph3P в 23 раза медленнее, чем n-O2NC6H4N3];
триалкилфосфины и фосфины ф-лы А1кnРАr3-n
(n = 1,2) активнее реагируют с азидами, чем Аr3Р. В р-ции
фосфинов с CF3N3 образующиеся иминофосфораны R3P
= NCF3 быстро превращаются в дифторфосфораны R3PF2.
Обычно р-цию проводят в орг. р-рителе
(напр., диэтиловом эфире, бензоле) при 0-50 °С. Окончание р-ции фиксируют
по прекращению выделения N2. Выходы высокие (во мн. случаях
близки к количественному).
Установлено, что Ш. р. протекает с промежут.
образованием продукта присоединения азида к фосфину (в ряде случаев такие
аддукты удается выделить). Причем вначале образуются продукты, имеющие
строение R3P = NN = NR' или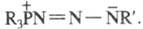 р-цию, подобную Ш. р., с азидами вступают также фосфиты (RO)3P,
фосфониты RP(OR)2, хлорфосфины R2PC1 и нек-рые др.
соед. трехкоординац. атома Р. Однако РН3, РС13, РhРС12
в обычных условиях с органилазидами не реагируют.
р-цию, подобную Ш. р., с азидами вступают также фосфиты (RO)3P,
фосфониты RP(OR)2, хлорфосфины R2PC1 и нек-рые др.
соед. трехкоординац. атома Р. Однако РН3, РС13, РhРС12
в обычных условиях с органилазидами не реагируют.
Р-цию используют в лаб. практике, открыта
Г. Штаудингером и И. Мейером в 1919.
Лит.: Фосфозосоединения, К., 1965, с. 100, 177-79; Leffler J., Temple R., "J. Atner. Chem. Soc.", 1967, v. 89, p. 5235-46.
3) Получение эписульфонов (тиираноксидов) действием SO2 на алифатич. диазосоединения (наз. также р-цией Штаудингера-Пфеннингера):
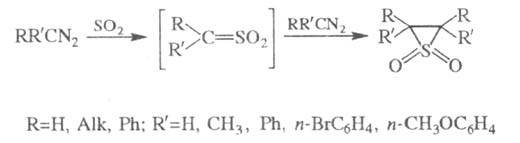
В р-ции образуется смесь
цис- и
транс-изомеров,
причем кол-во цис-изомера увеличивается с ростом полярности р-рителя.
Р-цию проводят в среде диэтилового эфира,
гексана или CS2 при охлаждении (до -40 °С). Выходы составляют
25-80%. Осн. побочные продукты - кетазины или 1,3,4-тиадиазолидиндиоксиды;
возможно также образование олефинов в результате отщепления SO2
от эписульфона при повышенных т-рах.
Несимметричные эписульфоны получают взаимод.
диазоалканов с сульфохлоридами в присут. оснований:
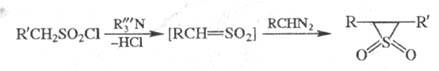
Считают, что в обеих р-циях на промежут.
стадии образуется высокореакционноспособный сульфен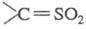 , к-рый связывается с диазоалканом с отщеплением N2.
, к-рый связывается с диазоалканом с отщеплением N2.
Р-цию используют в лаб. практике, открыта
Г. Штаудингером и Ф. Пфеннингером в 1916.
Лит.: Inhoffen H. [u. a.], "Annalen", 1966, № 694, S. 19-30; Fischer N., "Synthesis", 1970, № 8, p. 393-404.
Г. И. Дрозд.


