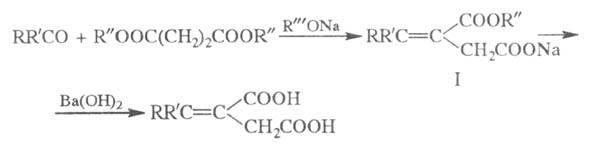
ШТОББЕ КОНДЕНСАЦИЯ, взаимод. альдегидов или кетонов с эфирами янтарной к-ты (сукцинатами) в присут. оснований с образованием алкилиденянтарных к-т:
В р-цию вступают алифатич. и ароматич.
альдегиды и кетоны, алициклич. кетоны,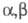 -ненасыщ.
альдегиды, дикетоны, кетоэфиры. В качестве конденсир. ср-в обычно применяют
C2Н5ONa, mpеm-C4H9OK
и NaH, реже - CH3ONa, C2HSOK, Na, Ph3CNa.
-ненасыщ.
альдегиды, дикетоны, кетоэфиры. В качестве конденсир. ср-в обычно применяют
C2Н5ONa, mpеm-C4H9OK
и NaH, реже - CH3ONa, C2HSOK, Na, Ph3CNa.
Обычно смесь кетона или альдегида, диалкилсукцината
и алкоголята Na в эфире выдерживают неск. суток при т-ре от -15 до 25 °С
и кратковременно нагревают смесь до кипения (иногда с целью сокращения
времени проведения р-ции и снижения выхода побочных продуктов, в качестве
р-рителя используют спирт, напр. этиловый, и нагревание смеси начинают
сразу после ее приготовления). Продукты р-ции гидролизуют, затем подкисляют
и выделяют моноэфир алкилиденянтарной к-ты (ф-ла I). Для омыления второй
эфирной группы моноэфир обрабатывают Ва(ОН)2 или NaOH. Выходы
обычно составляют 40-90%; как правило, лучшие результаты удается достичь
при использовании диметилсукцината и mpem-бутилата Na в
mpem-C4H9OH.
Осн. побочные процессы - восстановление
кетонов в спирты, Клайзена конденсация, Канниццаро реакция,
альдольная
конденсация, образование (преимущественно в мягких условиях) диалкилиденянтарных
(фульгеновых) к-т. Ароматич. альдегиды АrСНО иногда дают значит. кол-ва
производных параконовой к-ты (ф-лы II и III). Кетоны, имеющие один и более
атомов Н при a-атоме
С обычно на первой стадии Ш. к. дают алкенилянтарные эфиры R'CH = C(R)CH(COOC2H5)CH2COOH.
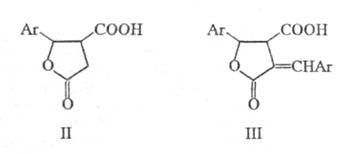
Механизм р-ции включает взаимод. диалкилсукцината с анионом RО- с образованием соответствующего карбаниона. Последний атакует атом С карбонильной группы альдегида или кетона с образованием нового аниона, стабилизирующегося в результате образования циклич. структуры лактона (его можно выделить), к-рый подвергается гидролизу:
В конденсацию, аналогичную Ш. к., вступает
также ди-трет-бутиловый эфир глутаровой к-ты. Соответствующие бензилиденовые
производные образуются при конденсации PhCHO с эфирами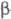 -бензоилпропионовой,
1,2,3-пропантрикарбоновой (трикарбаллиловой),
-бензоилпропионовой,
1,2,3-пропантрикарбоновой (трикарбаллиловой),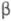 -(3,4-диметоксибензоил)-пропионовой
(
-(3,4-диметоксибензоил)-пропионовой
(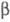 -вератроилпропионовой)
и тиодигликолевой к-т.
-вератроилпропионовой)
и тиодигликолевой к-т.
Ш. к. используют в синтезе ненасыщ. и
насыщ. (продукты гидрирования первых) замещенных производных янтарной к-ты
(лактонов, инданонов, тетралонов, полициклич. ароматич. соед., родственных
стероидам).
Р-ция открыта Г. Штоббе в 1893.
Лит.: Джонсон У., Доб Г., в сб.: Органические реакции, пер. с англ., сб. 6, М., 1953, с. 7; Martelli J. [а. о.], "Tetrahedron", 1974, № 17, р. 3063.
Г. И. Дрозд.


