ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ,
полный
или частичный распад молекул растворенного в-ва на катионы и анионы. Э.
д. называют также распад на катионы и анионы ионных кристаллов при растворении
или расплавлении. Э. д., как правило, происходит в полярных р-рителях.
При Э. д. разрываются обычно лишь наиб. полярные связи молекул, напр. карбоновые
к-ты RCOOH диссоциируют на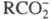 и Н+. Э. д. ; могут подвергаться молекулы нек-рых
р-рителей, напр. воды.
и Н+. Э. д. ; могут подвергаться молекулы нек-рых
р-рителей, напр. воды.
Осн. причинами Э. д. являются, с одной
стороны, взаимод. растворенного в-ва с р-рителем, к-рое приводит к сольватации
ионов, а с другой стороны - значит. ослабление электро-статич. взаимод.
между сольватир. ионами в среде, обусловленное ее электростатич. полем
(диэлектрич. проницаемостью р-рителя). При этом работа, необходимая для
разрушения молекул (кристаллич. решетки), обеспечивается за счет энергии
сольватации.
Э. д. лежит в основе деления р-ров на
два класса - растворы неэлектролитов и растворы электролитов.
Наблюдаемое
различие в коллигативных св-вах разбавленных р-ров электролитов и неэлектролитов
объясняется тем, что из-за Э. д. увеличивается общее число частиц в р-ре.
Это, в частности, приводит к увеличению осмотич. давления р-ра сравнительно
с р-рами неэлектролитов, понижению давления пара р-рителя над р-ром, увеличению
изменения т-ры кипения и замерзания р-ра относительно чистого р-рителя.
Э. д. объясняется также ионная электропроводность электролитов.
Мерой Э. д. является степень диссоциации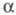 -
отношение кол-ва диссоциированных на ионы молекул электролита к их исходному
кол-ву в р-ре. Согласно этому определению,
-
отношение кол-ва диссоциированных на ионы молекул электролита к их исходному
кол-ву в р-ре. Согласно этому определению,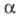 изменяется от 0 (отсутствие диссоциации) до 1 (полная диссоциация) и зависит
от природы растворенного в-ва и р-рителя, а также от концентрации р-ра
и т-ры. Как правило, с увеличением диэлектрич. проницаемости р-рителя
изменяется от 0 (отсутствие диссоциации) до 1 (полная диссоциация) и зависит
от природы растворенного в-ва и р-рителя, а также от концентрации р-ра
и т-ры. Как правило, с увеличением диэлектрич. проницаемости р-рителя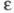 его
его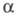 увеличивается,
хотя заметная диссоциация наблюдается в нек-рых р-рителях с низкой
увеличивается,
хотя заметная диссоциация наблюдается в нек-рых р-рителях с низкой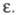
Способность данного в-ва MX к Э.д. в определенном
р-рителе по схеме MX M+
+ Х- характеризуется константой Э.д. KD,
связанной,
согласно действующих масс закону, со степенью диссоциации
M+
+ Х- характеризуется константой Э.д. KD,
связанной,
согласно действующих масс закону, со степенью диссоциации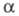 соотношением:
соотношением:

где х: - молярная концентрация электролита;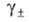 -
средний ионный коэф. активности;
-
средний ионный коэф. активности;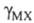 -
коэф. активности недиссоциированной части электролита. Как и
-
коэф. активности недиссоциированной части электролита. Как и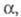 значение константы KD зависит от св-в растворенного в-ва,
в частности от прочности связи между фрагментами молекул электролита, образующими
катион и анион, от диэлектрич. св-в р-рителя, его способности сольватировать
ионы, а также от т-ры и давления; в отличие от
значение константы KD зависит от св-в растворенного в-ва,
в частности от прочности связи между фрагментами молекул электролита, образующими
катион и анион, от диэлектрич. св-в р-рителя, его способности сольватировать
ионы, а также от т-ры и давления; в отличие от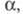 не зависит от концентрации р-ра. Константа KD м. б. определена
экспериментально, напр. по зависимости электропроводности р-ра от концентрации
электролита или путем прямого измерения содержания своб. ионов в р-ре,
напр., спектрофотометрич. методом.
не зависит от концентрации р-ра. Константа KD м. б. определена
экспериментально, напр. по зависимости электропроводности р-ра от концентрации
электролита или путем прямого измерения содержания своб. ионов в р-ре,
напр., спектрофотометрич. методом.
Соответственно понятиям полной и неполной
Э.д. электролиты классифицируют на сильные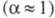 и слабые
и слабые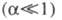 (см.
Электролиты),
полностью диссоциируют в р-ре многие соли неорг. к-т, нек-рые к-ты
и основания. Неполная Э.д. наблюдается для солей, катионы к-рых склонны
к образованию ковалентных связей с анионами, напр. соли Ag, Cd, Zn. Нек-рые
многоосновные к-ты, напр. H2SO4, полностью диссоциируют
лишь в отношении отщепления одного иона Н+, а дальнейшая диссоциация
(см.
Электролиты),
полностью диссоциируют в р-ре многие соли неорг. к-т, нек-рые к-ты
и основания. Неполная Э.д. наблюдается для солей, катионы к-рых склонны
к образованию ковалентных связей с анионами, напр. соли Ag, Cd, Zn. Нек-рые
многоосновные к-ты, напр. H2SO4, полностью диссоциируют
лишь в отношении отщепления одного иона Н+, а дальнейшая диссоциация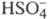 затруднена. Разб. р-ры слабых электролитов по своим св-вам близки к идеальным
р-рам, для них в ф-ле (1) коэф. активности можно считать равными 1. Тогда
ф-ла (1) переходит в закон разведения Оствальда:
затруднена. Разб. р-ры слабых электролитов по своим св-вам близки к идеальным
р-рам, для них в ф-ле (1) коэф. активности можно считать равными 1. Тогда
ф-ла (1) переходит в закон разведения Оствальда:
в к-ром а можно заменить отношением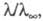 где
где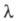 и
и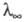 -соотв.
эквивалентная электропроводность р-ра при данной концентрации и при бесконечном
разведении. В соответствии с законом Оствальда с уменьшением концентрации
р-ра степень диссоциации а и эквивалентная электропроводность возрастают,
причем при бесконечном разведении
-соотв.
эквивалентная электропроводность р-ра при данной концентрации и при бесконечном
разведении. В соответствии с законом Оствальда с уменьшением концентрации
р-ра степень диссоциации а и эквивалентная электропроводность возрастают,
причем при бесконечном разведении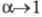 и
и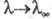 (см.
Электропроводность электролитов). Р-ры сильных электролитов не являются
идеальными и для их описания необходим учет межионного взаимод. даже в
области предельного разведения. При определенных условиях, напр. в р-рителях
с малой диэлектрич. проницаемостью, при низких т-рах или при образовании
многовалентных ионов, благодаря сильному электростатич. притяжению противоположно
заряженных ионов могут образовываться ионные ассоциаты, простейшими из
к-рых являются ионные пары. Равновесие между сольватир. ионами и ионными
парами характеризуется константой диссоциации, аналогично исходному распаду
молекул, или обратной ей величиной - константой ассоциации. В приближении
электростатич. взаимод. между ионами константа диссоциации контактных ионных
пар, образованных двумя ионами с радиусами r+ и r.
и зарядовыми числами z+ и z-, м. б. рассчитана
по ф-ле:
(см.
Электропроводность электролитов). Р-ры сильных электролитов не являются
идеальными и для их описания необходим учет межионного взаимод. даже в
области предельного разведения. При определенных условиях, напр. в р-рителях
с малой диэлектрич. проницаемостью, при низких т-рах или при образовании
многовалентных ионов, благодаря сильному электростатич. притяжению противоположно
заряженных ионов могут образовываться ионные ассоциаты, простейшими из
к-рых являются ионные пары. Равновесие между сольватир. ионами и ионными
парами характеризуется константой диссоциации, аналогично исходному распаду
молекул, или обратной ей величиной - константой ассоциации. В приближении
электростатич. взаимод. между ионами константа диссоциации контактных ионных
пар, образованных двумя ионами с радиусами r+ и r.
и зарядовыми числами z+ и z-, м. б. рассчитана
по ф-ле:
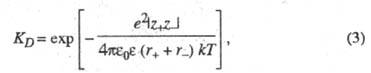
где е - элементарный электрич. заряд;
k - постоянная Больцмана;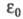 -
электрич. постоянная (диэлектрич. проницаемость вакуума) ;
-
электрич. постоянная (диэлектрич. проницаемость вакуума) ;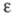 -
диэлектрич. проницаемость р-рителя; Т - абс. т-ра.
-
диэлектрич. проницаемость р-рителя; Т - абс. т-ра.
Понятие Э.д. было введено С. Аррениусом
в 1887. Э.д. играет важную роль во мн. прир. и производств, процессах,
определяя как св-ва р-ров электролитов, так и особенности происходящих
в них процессов (см. Реакции в растворах).
Лит.: Измайлов Н.А., Электрохимия растворов, 3 изд., М., 1976; Monk С. В., Electrolytic dissociation, L.-N. Y., 1961.
М. Ф. Головко.


