ЭНЕРГИЯ АКТИВАЦИИ в элементарных
р-циях, миним. энергия реагентов (атомов, молекул и др. частиц), достаточная
для того, чтобы они вступили в хим. р-цию, т. е. для преодоления барьера
на пов-сти потенциальной энергии, отделяющего реагенты от продуктов р-ции.
Потенциальный барьер - максимум потенциальной энергии, через к-рый должна
пройти система в ходе элементарного акта хим. превращения. Высота потенциального
барьера для любого пути, проходящего через переходное состояние, равна
потенциальной энергии в переходном состоянии. Если в сложной р-ции, состоящей
из последовательных и параллельных элементарных р-ций, имеется лимитирующая
элементарная р-ция (р-ция с макс. характерным временем), то ее Э. а. является
и Э. а. сложной р-ции. В макроскопич. хим. кинетике Э. а.- энергетич. параметр
Еа,
входящий
в Аррениуса уравнение: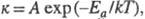 где к - константа скорости; А - предэкспоненциальный множитель
(постоянная или слабо зависящая от т-ры величина); k - константа
Больцмана; Т - абс. т-ра. График зависимости lnk от 1/kT
(аррениусов
график) - прямая линия. Наблюдаемая Э. а. вычисляется из тангенса угла
наклона этой прямой. В общем случае сложных р-ций параметр
Еа в
ур-нии Аррениуса является ф-цией Э. а. отдельных стадий, и определяемая
Э. а. наз. эффективной (эмпирической, кажущейся).
где к - константа скорости; А - предэкспоненциальный множитель
(постоянная или слабо зависящая от т-ры величина); k - константа
Больцмана; Т - абс. т-ра. График зависимости lnk от 1/kT
(аррениусов
график) - прямая линия. Наблюдаемая Э. а. вычисляется из тангенса угла
наклона этой прямой. В общем случае сложных р-ций параметр
Еа в
ур-нии Аррениуса является ф-цией Э. а. отдельных стадий, и определяемая
Э. а. наз. эффективной (эмпирической, кажущейся).
Любой процесс, сопровождающийся к.-л.
изменением энергии, является экзотермическим в одном направлении и эндотермическим
в другом. Э. а. экзотермич. и эндотермич. направлений р-ции, обозначаемые
соотв.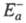 и
и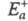 , связаны
соотношением:
, связаны
соотношением: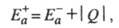
где Q - .теплота р-ции при Т=
0.
Качественная одномерная геом. иллюстрация связи Э. а. с высотой потенциального
барьера и теплотой р-ции представлена на рис., где q -координата реакции
(см. также Активированного комплекса теория); Е1 и
Е2 - уровни энергии соотв. основного состояния
реагентов и продуктов р-ции.
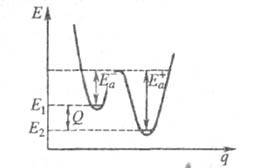
Энергетич. схема элементарной реакции.
Для р-ций рекомбинации своб. радикалов
(в т. ч. и атомов), а также для широкого класса экзотермич. ионно-молекулярных
реакций Э. а. равна нулю или очень мала по сравнению с типичными значениями
энергий хим. связей Есв. Для р-ций, сопровождающихся
одновременно разрывом одних и образованием других хим. связей,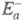 составляет обычно от сотых до десятых долей Есв, если
среди реагентов есть своб. радикалы, и сравнима с Есв ,
если
реагенты - химически насыщенные молекулы.
составляет обычно от сотых до десятых долей Есв, если
среди реагентов есть своб. радикалы, и сравнима с Есв ,
если
реагенты - химически насыщенные молекулы.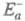 м. б. аномально большой (напр., больше энергии возбуждения атома Е*)
в р-циях тушения электронного возбуждения при столкновениях атомов: А*
+ А
м. б. аномально большой (напр., больше энергии возбуждения атома Е*)
в р-циях тушения электронного возбуждения при столкновениях атомов: А*
+ А А + А,
если точка пересечения термов реагентов и продуктов р-ции расположена высоко
по сравнению с Е* или термы не пересекаются.
А + А,
если точка пересечения термов реагентов и продуктов р-ции расположена высоко
по сравнению с Е* или термы не пересекаются.
Известны эмпирич. корреляции, устанавливающие
приближенную связь между Еа и Q для однотипных
р-ций, напр. правило Поляни-Семенова:
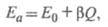
где Е0и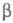 - константы. Теоретич. расчеты Еа производятся приближенными
методами квантовой химии. Точные последовательные квантовомех. вычисления
выполнены пока для систем, содержащих не более 3 электронов, напр. для
3 атомов водорода.
- константы. Теоретич. расчеты Еа производятся приближенными
методами квантовой химии. Точные последовательные квантовомех. вычисления
выполнены пока для систем, содержащих не более 3 электронов, напр. для
3 атомов водорода.
Для придания системе необходимой Э. а.
используют нагревание, действие электромагнитного излучения и др., а также
вводят катализаторы, направляющие хим. р-ции по пути с меньшей Э. а.
Лит.: Кондратьев В. Н., Никитин Е. Е., Тальрозе В. Л., в кн.: Низкотемпературная плазма, М., 1967, с. 13-34; Термические бимолекулярные реакции в газах, М., 1976; Кузнецов Н.М., Савров С.Д., "Химическая физика", 1990, т. 9, № 3, с. 356-69.
Н. М. Кузнецов.


