ЭТИЛБЕНЗОЛ, С6Н5СН2СН3,
мол. м. 106,16; бесцв. жидкость с запахом бензола; т. пл. -94,97 °С, т.
кип. 136,19 °С, 25,88 оС/10 мм рт. ст.;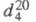 0,8671;
0,8671;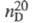 1,4958;
1,4958;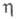 0,637 мПа х с (20 °С);
0,637 мПа х с (20 °С);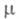 1,97 х 10-30 Кл х м;
1,97 х 10-30 Кл х м;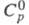 (жидкость) 186,56 Дж/(моль-К),
(жидкость) 186,56 Дж/(моль-К),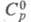 (газ) 128,49 Дж/(моль х К);
(газ) 128,49 Дж/(моль х К);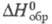 (жидкость) -12,48 кДж/моль,
(жидкость) -12,48 кДж/моль,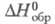 (газ) -29,71 кДж/моль;
(газ) -29,71 кДж/моль;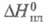 86,3 Дж/г,
86,3 Дж/г,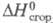 -4568,6 кДж/моль;
-4568,6 кДж/моль;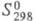 (жидкость) 255,35 Дж/(моль х К),
(жидкость) 255,35 Дж/(моль х К),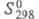 (газ) 360,69 Дж/(моль х К);
(газ) 360,69 Дж/(моль х К);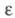 2,41 (20 °С). Р-римость в воде 0,014 г в 100 г (15 °С); смешивается с большинством
орг. р-рителей. Образует пикрат с т. пл. 96,6 °С.
2,41 (20 °С). Р-римость в воде 0,014 г в 100 г (15 °С); смешивается с большинством
орг. р-рителей. Образует пикрат с т. пл. 96,6 °С.
Обладает св-вами ароматических соединений.
При
действии Cl2 или Вr2 на Э. в газовой фазе в отсутствие
катализатора на свету или при т-ре кипения Э. происходит замещение в боковой
цепи с образованием (1-галогенэтил)- и (2-галогенэтил)бензолов. Галогенирование
в жидкой фазе при низких т-рах в присут. катализаторов (А1С13,
FeBr3, I2 и др.) приводит к о-
и
n-галогенпроизводным.
Нитрование HNO3 (d= 1,5) и сульфирование идет в бензольное
кольцо с образованием соответствующих моно-, ди- и тринитропроизводных.
При окислении СrО3 или разб. HNO3 Э. превращается
в бензойную к-ту и ацетофенон, при окислении р-ром Na2Cr2O7
в автоклаве при т-ре 250 °С в течение 1 ч - в натриевую соль фенилуксусной
к-ты (выход 89%). Жидкофазное окисление Э. в присут. ацетата Мn приводит
к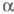 -фенилэтиловому
спирту, к-рый при 300 °С в присут. TiO2 превращается в стирол.
При окислении кислородом воздуха при 130 °С и 0,5 МПа Э. образует гидропероксид,
к-рый при 11О °С в присут. нафтенатов W или Мо с пропиленом образует пропиленоксид
и
-фенилэтиловому
спирту, к-рый при 300 °С в присут. TiO2 превращается в стирол.
При окислении кислородом воздуха при 130 °С и 0,5 МПа Э. образует гидропероксид,
к-рый при 11О °С в присут. нафтенатов W или Мо с пропиленом образует пропиленоксид
и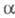 -фенилэтиловый
спирт.
-фенилэтиловый
спирт.
При пропускании паров при 360 °С над катализатором
на основе оксидов Zn или Сr Э. с выходом 90-92% дегидрируется в стирол.
Э. содержится в сырой нефти, продуктах
каталитич. риформинга нефтяных фракций и легких фракциях смолы коксования
угля, откуда он м. б. легко выделен. В пром-сти Э. получают гл. обр. алкилированием
бензола этиленом в присут. А1С13 при т-ре 400-450 °С; разработаны
также процессы алкилирования в присут. BF3 на модифицированном
оксиде А1, Н3РО4 на кизельгуре, мол. ситах.
Э. - исходное в-во в произ-ве стирола,
добавка к моторному топливу для повышения октанового числа, р-ритель.
Э. раздражает кожу, оказывает судорожное
действие; ЛД50 3,5 г/кг (мыши, внутрижелудочно). ПДК в атм.
воздухе 0,02 мг/м3, в водоемах хозяйств.-бытового пользования
0,01 мг/л. Т. воспл. 15 °С, т. самовоспл. 432 °С, КПВ 0,9-3,9% по объему.
Объем мирового произ-ва ок. 17 млн. т
в год (1987); объем произ-ва в России 0,8 млн. т в год (1990).
Лит.: Теддер Дж., Нехватал А., Джубб А., Промышленная органическая химия, пер. с англ., М., 1977; Kirk-Othmer encyclopedia, 3 ed., v. 15, N. Y, 1981, p. 545; v. 24, 1984, p. 709.
В. Г. Липович, М. Ф. Вагин.


