ДИЕНОВЫЙ СИНТЕЗ (р-ция Дильса - Альдера), 1,4-циклоприсоединение в-в, содержащих активированную кратную связь ("диенофилов"), к соед. с сопряженными кратными. связями ("диенам") с образованием 6-членных циклов:
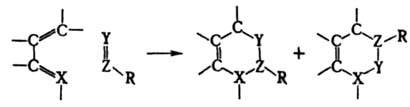
Диенофилами обычно служат олефины и ацетилены, кратная связь у к-рых активирована электроноакцепторной группой R, а также в-ва, содержащие в молекуле группы —C=N, =C=N—, =С=О, — N=N—, =S=О и др. Диенами м. б. ациклич. и циклич. 1,3-диены, ароматич. и гетероциклич. соединения, в-ва, содержащие в молекуле фрагменты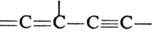 ,
, 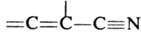 ,
, 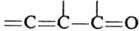 ,
, 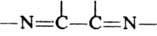 , и др. Необходимое условие Д. с. - s-цисоидная конформация диена.
Д. с. проводят в р-рителе или без него в широком интервале т-р (от -100 до 200 °С), при УФ облучении, без катализатора или в его присутствии (обычно применяют к-ты Льюиса). В зависимости от природы заместителей в реагентах и от условий проведения Д. с. может протекать по синхронному одностадийному механизму (см. Перициклические реакции)
или как двустадийный процесс с участием бирадикальных либо цвиттер-ионных интермедиатов. Обычно Д. с. протекает в соответствии с Вудворда-Хофмана правилами, согласно к-рым супраповерхностное p2 + p4 взаимод. (p-тип орбитали, числа - кол-во взаимодействующих электронов диена и диенофила) высшей занятой мол. орбитали (ВЗМО) и низшей свободной мол. орбитали (НСМО) диена и диенофила в осн. состояниях разрешено по симметрии и может протекать синхронно. Т.к. степень взаимод. двух мол. орбиталей обратно пропорциональна разнице их энергий, авт. наз. нормальной р-ции Д. с. участвуют ВЗМО диена и НСМО диенофила, то р-ция обычно облегчается при наличии электроноакцепторных заместителей в молекуле диенофила и электронодонорных в молекуле диена. Любые факторы (стерические, конформационные и т.п.), уменьшающие комплементарность пары диенофил - диен, способствуют протеканию р-ции по ступенчатому механизму и в более жестких условиях.
Т.к. ориентация реагентов определяется распределением электронной плотности в молекулах диена и диенофила, регио- и стереоселективность Д. с. обычно довольно высока, хотя изомерный состав продуктов р-ции может зависеть как от термодинамич., так и от кинетич. факторов. В последнем случае для циклич. диенов часто справедливо т. наз. правило эндоприсоединения, или накопления насыщенности. Согласно этому правилу, реагенты обычно располагаются в параллельных плоскостях таким образом, чтобы расстояние между ненасыщенной группой диенофила и p-электронами диена было минимальным, напр.:
, и др. Необходимое условие Д. с. - s-цисоидная конформация диена.
Д. с. проводят в р-рителе или без него в широком интервале т-р (от -100 до 200 °С), при УФ облучении, без катализатора или в его присутствии (обычно применяют к-ты Льюиса). В зависимости от природы заместителей в реагентах и от условий проведения Д. с. может протекать по синхронному одностадийному механизму (см. Перициклические реакции)
или как двустадийный процесс с участием бирадикальных либо цвиттер-ионных интермедиатов. Обычно Д. с. протекает в соответствии с Вудворда-Хофмана правилами, согласно к-рым супраповерхностное p2 + p4 взаимод. (p-тип орбитали, числа - кол-во взаимодействующих электронов диена и диенофила) высшей занятой мол. орбитали (ВЗМО) и низшей свободной мол. орбитали (НСМО) диена и диенофила в осн. состояниях разрешено по симметрии и может протекать синхронно. Т.к. степень взаимод. двух мол. орбиталей обратно пропорциональна разнице их энергий, авт. наз. нормальной р-ции Д. с. участвуют ВЗМО диена и НСМО диенофила, то р-ция обычно облегчается при наличии электроноакцепторных заместителей в молекуле диенофила и электронодонорных в молекуле диена. Любые факторы (стерические, конформационные и т.п.), уменьшающие комплементарность пары диенофил - диен, способствуют протеканию р-ции по ступенчатому механизму и в более жестких условиях.
Т.к. ориентация реагентов определяется распределением электронной плотности в молекулах диена и диенофила, регио- и стереоселективность Д. с. обычно довольно высока, хотя изомерный состав продуктов р-ции может зависеть как от термодинамич., так и от кинетич. факторов. В последнем случае для циклич. диенов часто справедливо т. наз. правило эндоприсоединения, или накопления насыщенности. Согласно этому правилу, реагенты обычно располагаются в параллельных плоскостях таким образом, чтобы расстояние между ненасыщенной группой диенофила и p-электронами диена было минимальным, напр.:
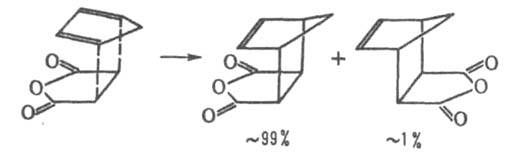
Нагревание продуктов Д. с. часто приводит к их распаду на исходные компоненты или к образованию новой пары "диен"-"диенофил" (ретро-реакция Д.с.), напр.:
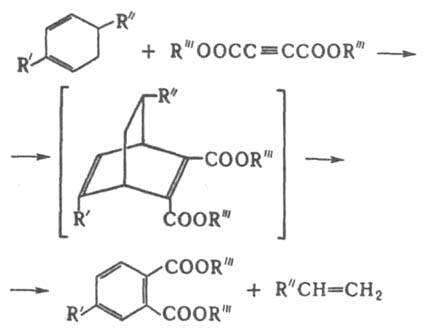
Один из вариантов Д. с.- р - ц и я " д о м и н о ", в результате к-рой образуется соед., содержащее диеновый и диенофилъный фрагменты и реагирующее далее внутримолекулярной по схеме Д. с.:
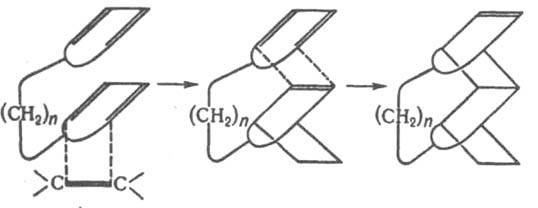
Модификация Д. с. - взаимод. диенофила с несопряженными диенами, имеющими подходящее пространств. расположение двойных связей, с образованием двух новых циклов (гомо-реакция Д. с.), напр.:
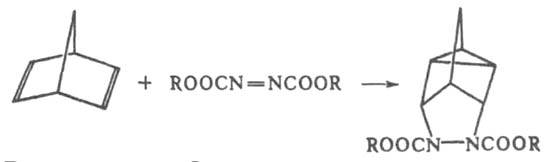
Д. с.- одна из наиб. широко применяемых в орг. химии р-ций. Она используется для синтеза полициклич. соед., в т. ч. природных, а также для идентификации и количеств. определения диенов. Как общая р-ция орг. химии описана О. Дильсом и К. Алъдером в 1928. Лит.: Онищенко А. С., Диеновый синтез, М., 1963; Ахрем А. А., Титов Ю. А., в кн.: Реакции и методы исследования органических соединений, т. 14, М., 1964, с. 7-172; Вассерман А., Реакция Дильса - Альдера, пер. с англ., М., 1968; Марч Дж., Органическая химия, пер. с англ., т. 3, М., 1987, с. 15-47; Ноuk К., в кн.: Pericyclic reactions, ed. by A. Marchand, R. Lehr, v. 2, N. Y., 1977, p. 181-271; Sauer J., Sustmann R., "Angew. Chem., InL Ed. Engl.", 1980, v. 19, № 10, p. 779-807; Dewar M. J. S., Olivella S.. Stewart J. J. P., "J. Am. Chem. Soc.", 1986, v. 108, № 19, p. 5771-79. Д.И. Махоньков.

Диенофилами обычно служат олефины и ацетилены, кратная связь у к-рых активирована электроноакцепторной группой R, а также в-ва, содержащие в молекуле группы —C=N, =C=N—, =С=О, — N=N—, =S=О и др. Диенами м. б. ациклич. и циклич. 1,3-диены, ароматич. и гетероциклич. соединения, в-ва, содержащие в молекуле фрагменты
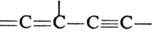 ,
, 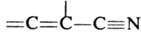 ,
, 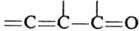 ,
, 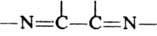 , и др. Необходимое условие Д. с. - s-цисоидная конформация диена.
Д. с. проводят в р-рителе или без него в широком интервале т-р (от -100 до 200 °С), при УФ облучении, без катализатора или в его присутствии (обычно применяют к-ты Льюиса). В зависимости от природы заместителей в реагентах и от условий проведения Д. с. может протекать по синхронному одностадийному механизму (см. Перициклические реакции)
или как двустадийный процесс с участием бирадикальных либо цвиттер-ионных интермедиатов. Обычно Д. с. протекает в соответствии с Вудворда-Хофмана правилами, согласно к-рым супраповерхностное p2 + p4 взаимод. (p-тип орбитали, числа - кол-во взаимодействующих электронов диена и диенофила) высшей занятой мол. орбитали (ВЗМО) и низшей свободной мол. орбитали (НСМО) диена и диенофила в осн. состояниях разрешено по симметрии и может протекать синхронно. Т.к. степень взаимод. двух мол. орбиталей обратно пропорциональна разнице их энергий, авт. наз. нормальной р-ции Д. с. участвуют ВЗМО диена и НСМО диенофила, то р-ция обычно облегчается при наличии электроноакцепторных заместителей в молекуле диенофила и электронодонорных в молекуле диена. Любые факторы (стерические, конформационные и т.п.), уменьшающие комплементарность пары диенофил - диен, способствуют протеканию р-ции по ступенчатому механизму и в более жестких условиях.
Т.к. ориентация реагентов определяется распределением электронной плотности в молекулах диена и диенофила, регио- и стереоселективность Д. с. обычно довольно высока, хотя изомерный состав продуктов р-ции может зависеть как от термодинамич., так и от кинетич. факторов. В последнем случае для циклич. диенов часто справедливо т. наз. правило эндоприсоединения, или накопления насыщенности. Согласно этому правилу, реагенты обычно располагаются в параллельных плоскостях таким образом, чтобы расстояние между ненасыщенной группой диенофила и p-электронами диена было минимальным, напр.:
, и др. Необходимое условие Д. с. - s-цисоидная конформация диена.
Д. с. проводят в р-рителе или без него в широком интервале т-р (от -100 до 200 °С), при УФ облучении, без катализатора или в его присутствии (обычно применяют к-ты Льюиса). В зависимости от природы заместителей в реагентах и от условий проведения Д. с. может протекать по синхронному одностадийному механизму (см. Перициклические реакции)
или как двустадийный процесс с участием бирадикальных либо цвиттер-ионных интермедиатов. Обычно Д. с. протекает в соответствии с Вудворда-Хофмана правилами, согласно к-рым супраповерхностное p2 + p4 взаимод. (p-тип орбитали, числа - кол-во взаимодействующих электронов диена и диенофила) высшей занятой мол. орбитали (ВЗМО) и низшей свободной мол. орбитали (НСМО) диена и диенофила в осн. состояниях разрешено по симметрии и может протекать синхронно. Т.к. степень взаимод. двух мол. орбиталей обратно пропорциональна разнице их энергий, авт. наз. нормальной р-ции Д. с. участвуют ВЗМО диена и НСМО диенофила, то р-ция обычно облегчается при наличии электроноакцепторных заместителей в молекуле диенофила и электронодонорных в молекуле диена. Любые факторы (стерические, конформационные и т.п.), уменьшающие комплементарность пары диенофил - диен, способствуют протеканию р-ции по ступенчатому механизму и в более жестких условиях.
Т.к. ориентация реагентов определяется распределением электронной плотности в молекулах диена и диенофила, регио- и стереоселективность Д. с. обычно довольно высока, хотя изомерный состав продуктов р-ции может зависеть как от термодинамич., так и от кинетич. факторов. В последнем случае для циклич. диенов часто справедливо т. наз. правило эндоприсоединения, или накопления насыщенности. Согласно этому правилу, реагенты обычно располагаются в параллельных плоскостях таким образом, чтобы расстояние между ненасыщенной группой диенофила и p-электронами диена было минимальным, напр.:

Нагревание продуктов Д. с. часто приводит к их распаду на исходные компоненты или к образованию новой пары "диен"-"диенофил" (ретро-реакция Д.с.), напр.:

Один из вариантов Д. с.- р - ц и я " д о м и н о ", в результате к-рой образуется соед., содержащее диеновый и диенофилъный фрагменты и реагирующее далее внутримолекулярной по схеме Д. с.:

Модификация Д. с. - взаимод. диенофила с несопряженными диенами, имеющими подходящее пространств. расположение двойных связей, с образованием двух новых циклов (гомо-реакция Д. с.), напр.:
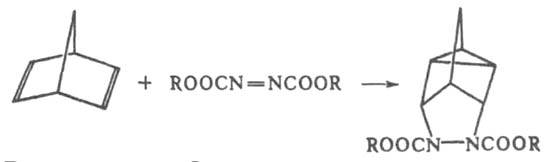
Д. с.- одна из наиб. широко применяемых в орг. химии р-ций. Она используется для синтеза полициклич. соед., в т. ч. природных, а также для идентификации и количеств. определения диенов. Как общая р-ция орг. химии описана О. Дильсом и К. Алъдером в 1928. Лит.: Онищенко А. С., Диеновый синтез, М., 1963; Ахрем А. А., Титов Ю. А., в кн.: Реакции и методы исследования органических соединений, т. 14, М., 1964, с. 7-172; Вассерман А., Реакция Дильса - Альдера, пер. с англ., М., 1968; Марч Дж., Органическая химия, пер. с англ., т. 3, М., 1987, с. 15-47; Ноuk К., в кн.: Pericyclic reactions, ed. by A. Marchand, R. Lehr, v. 2, N. Y., 1977, p. 181-271; Sauer J., Sustmann R., "Angew. Chem., InL Ed. Engl.", 1980, v. 19, № 10, p. 779-807; Dewar M. J. S., Olivella S.. Stewart J. J. P., "J. Am. Chem. Soc.", 1986, v. 108, № 19, p. 5771-79. Д.И. Махоньков.


