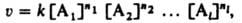
где [Ai] (i=1,2,...,l) - концентрация i-го в-ва, ni-порядок реакции по i-му в-ву, k-константа скорости р-ции.
Обычно экспериментально изучают р-ции в замкнутой системе при постоянном объеме и представляют результаты графически в виде т. наз. кинетич. кривой, выражающей зависимость концентрации реагента или продукта от времени t. Аналит. вид этой зависимости наз. ур-нием кинетич. кривой. В отличие от К.у., ур-ния кривых расходования реагирующих в-в или накопления продукта содержат в качестве параметров начальные концентрации компонентов в момент времени t=0. Так, для бимолекулярной р-ции 2А:Z кривая накопления продукта Z выражается ур-нием:
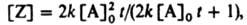
где [А]0 = [А] при t=0.
Дифференцированием этого ур-ния можно получить К.у.
р-ции:
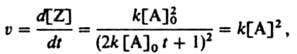
к-рое не зависит от начальных условий и потому имеет более широкое применение.
Сложная р-ция состоит из неск. стадий, совокупность и последовательность к-рых представляет собой механизм реакции. Предполагаемый механизм р-ции наз. ее кинетич. схемой. Кинетика сложной р-ции с неск. промежут. продуктами описывается системой дифференц. К. у. Если в к.-л. из стадий скорости образования и расходования промежут. продукта очень близки и в реакц. смеси устанавливается его квазистационарная концентрация, систему К. у. можно упростить и перейти от дифференциальных к алгебраич. ур-ниям (см. Квазистационарности приближение). В ряде случаев это позволяет получить для сложной р-ции одно К. у. В нестационарном режиме, при к-ром концентрация каждого промежут. продукта отличается от квазиравновесной, система дифференц. К.у. сложной р-ции решается, как правило, с помощью ЭВМ.
Следует различать эмпирич. К.у., к-рое получают на основании измеренных значений v при варьировании концентраций всех участвующих в р-ции в-в (реагентов, катализатора, инициатора, ингибитора) и теоретич. К.у., к-рое выводится математически из предполагаемой кинетич. схемы р-ции. Совпадение эмпирич. К.у. с теоретическим свидетельствует о достоверности кинетич. схемы р-ции.
Лит. см. при ст Кинетика химическая Е. Т Денисов


