ПОРЯДОК РЕАКЦИИ
по данному в-ву, показатель степени при концентрации этого в-ва в кинетич..
ур-нии р-ции. Согласно действующих масс закону, скорость у простой (одностадийной)
р-ции между в-вами А и В типа nАА + nBB
: продукты равна:
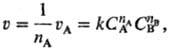
где uА-скорость
расходования реагента А, СА и Св-концентрации
реагентов А и В, k - константа скорости р-ции, nА и
nв-П.р. по реагентам А и В соотв., п = nА
+ nв-общий П. р. (nА и nв-
частные П. р.). Для гомог. р-ции П. р. по данному в-ву представляет собой стехиометрич.
коэф. этого в-ва в ур-нии р-ции. Напр., в р-ции 2NO + С12 :
2NOC1 П. р. по NO равен 2, П. р. по С12 равен 1, а общий П. р. равен
3. Для простых р-ций П. р. всегда целое число (1, 2 или 3).
Для сложных р-ций П. р.
редко совпадают с суммой стехиометрич. коэф., он м. б. числом переменным, дробным
и даже отрицательным. Напр., для параллельных р-ций типа
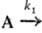 продукты;
продукты;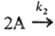 продукты
(k1 и k2- константы скорости
для соответствующих стадий) суммарная скорость расходования А составляет uА
= k1СА +
продукты
(k1 и k2- константы скорости
для соответствующих стадий) суммарная скорость расходования А составляет uА
= k1СА +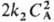 и
П. р. меняется по
мере увеличения СА от 1 (uA — k1
СА) до 2 (uА =
и
П. р. меняется по
мере увеличения СА от 1 (uA — k1
СА) до 2 (uА =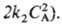 Для
цепной р-ции типа+
Для
цепной р-ции типа+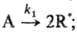
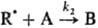 +
+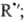
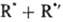
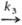 D
в условиях, когда k1CA
D
в условиях, когда k1CA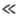
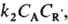 скорость
расходования А составляет
скорость
расходования А составляет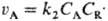 ,
т. к.
,
т. к. 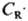 =
(k1 CA/k3)1/2,
то
=
(k1 CA/k3)1/2,
то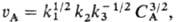 так что
nА = 3/2. Для мономолекулярного
превращения А в присут. В, образующего с А неактивный комплекс (А
так что
nА = 3/2. Для мономолекулярного
превращения А в присут. В, образующего с А неактивный комплекс (А продукты; А + В
продукты; А + В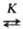 D),
скорость р-ции
D),
скорость р-ции 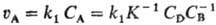 (К- константа
равновесия). Если равновесие сдвинуто вправо (CD
(К- константа
равновесия). Если равновесие сдвинуто вправо (CD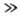 CA),
П.р. по В равен -1.
CA),
П.р. по В равен -1.
Если зависимость скорости
расходования исходного реагента или скорости накопления продукта сложной р-ции
от соответствующих концентраций не описывается степенной ф-цией, говорить о
П. р. по данному реагенту (продукту) не имеет смысла. Напр., скорость превращения
субстрата S.
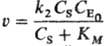
в присут. фермента Е составляет(KM-константа
Михаэлиса) и зависит от начальнойконцентраций фермента 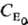 в первой степени, а зависимость от концентрации
субстрата Cs не степенная. Такая р-ция имеет первый порядок
по ферменту, говорить же о П. р. по субстрату не имеет смысла.
в первой степени, а зависимость от концентрации
субстрата Cs не степенная. Такая р-ция имеет первый порядок
по ферменту, говорить же о П. р. по субстрату не имеет смысла.
Существует ряд эмпирич.
методов определения П. р. 1) Проводят серию опытов с переменной концентрацией
реагента А, определяют начальную скорость его расходования uА
и находят П. р. как отношение: nА = dln uA/dln
CA. 2) Все реагенты, кроме А, берут в избытке, скорость расходования
A ut измеряют в разные моменты времени t, П. р.
находят как отношение: nА = dln ut/dln
CA. 3) Измеряют время t1/p превращения
А на 1/p-ю часть, когда все реагенты, кроме А, взяты в избытке. Это время
не зависит от начальной концентрации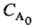 в-ва
А, если nА = 1; оно обратно пропорционально
в-ва
А, если nА = 1; оно обратно пропорционально 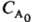 при nА = 2 и обратно пропорционально
при nА = 2 и обратно пропорционально 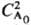 при nА = 3. Так, для превращения на 50% t1/2
= k-1 ln 2 при nА = 1; tl/2
= (k
при nА = 3. Так, для превращения на 50% t1/2
= k-1 ln 2 при nА = 1; tl/2
= (k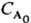 )-1
при nА = 2 и t1/2 = 3/2k при nА
= 3. Здесь k-константа скорости р-ции, если
)-1
при nА = 2 и t1/2 = 3/2k при nА
= 3. Здесь k-константа скорости р-ции, если 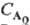 в
р-ции участвует только один реагент А; если же А реагирует с В, то k равна
константе скорости, умноженной на начальную концентрацию В. В общем случае для
п — 1 t1/p = k-1ln[p/(p-l)],
a для n.1 t1/р={[p/p-1]n-1-—
1}
в
р-ции участвует только один реагент А; если же А реагирует с В, то k равна
константе скорости, умноженной на начальную концентрацию В. В общем случае для
п — 1 t1/p = k-1ln[p/(p-l)],
a для n.1 t1/р={[p/p-1]n-1-—
1}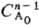 ·(п — 1)k.
4) Следят за расходованием А и определяют П. р. по кинетич. кривой (см. Кинетическое
уравнение). Если nА = 1, то А расходуется по экспоненц.
закону и uА = e-kt. Если я = 2, то кинетич.
кривая описывается ф-лой:
·(п — 1)k.
4) Следят за расходованием А и определяют П. р. по кинетич. кривой (см. Кинетическое
уравнение). Если nА = 1, то А расходуется по экспоненц.
закону и uА = e-kt. Если я = 2, то кинетич.
кривая описывается ф-лой: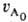 uА
=
uА
=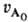 (1 + 2k
(1 + 2k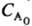 t)-2.
По совпадению эксперим. данных с одной из этих ф-л определяют nА
.
t)-2.
По совпадению эксперим. данных с одной из этих ф-л определяют nА
.
Если продукты р-ции влияют
на ее протекание, напр. при автокатализе, кинетич. ур-ние становится
приближенным. В этих случаях наиб. надежным является 1-й метод определения П.
р. Общий П. р. можно определить любым из перечисл. методов, проводя р-цию со
стехиометрич. смесью реагентов.
Лит. см. при ст.
Кинетика химическая. Е. Т. Денисов.


