СУПЕРОКСИДДИСМУТАЗЫ
(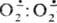 -оксидоредуктазы,
СОД), ферменты класса
оксидоредуктаз, катализирующие диспропорционирование супероксидного анион-радикала:
-оксидоредуктазы,
СОД), ферменты класса
оксидоредуктаз, катализирующие диспропорционирование супероксидного анион-радикала:
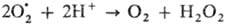
Анион-радикал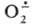 образуется
в организме из О2 при фагоцитозе (поглощении бактерий, фрагментов
клетки или др. частиц нек-рыми клетками). При ряде патологич. состояний (напр.,
при ишемии ткани)
образуется
в организме из О2 при фагоцитозе (поглощении бактерий, фрагментов
клетки или др. частиц нек-рыми клетками). При ряде патологич. состояний (напр.,
при ишемии ткани) может
играть важную роль в развитии заболевания.
может
играть важную роль в развитии заболевания.
С. присутствуют во всех
тканях аэробионтов (обитатели суши и воздуха). В клетках млекопитающих С. в
осн. локализованы в цитозоле; ок. 10% фермента (по массе) находится в митохондриальных
мембранах.
Молекула изофермента С.
из цитозоля состоит из 2 идентичных субъединиц с мол. м. 16 тыс., каждая из
к-рых содержит по 1 атому Сu2+ и Zn2+ . Фермент активен
при рН 6-10, ингибируется NaCN и м.б. экстрагирован смесью хлороформ-этанол.
Изофермент, содержащий в качестве кофермента Сu2+ и Zn2+,
обнаружен также в матриксе митохондрий и в ядрах, а также в зрелых эритроцитах.
Изофермент митохондриальных
мембран состоит из 4 идентичных субъединиц с мол. м. 20 тыс., каждая из к-рых
содержит по 1 атому Мn3+ на субъединицу. Оптим. ката-литич. активность
такой С. при рН ок. 7; фермент не ингибируется NaCN, разрушается при обработке
смесью хлороформ-этанол. Mn-содержащий изофермент, выделенный из бактерий, в
отличие от митохондриального тетра-мера является димером. В бактериях Escherichia
coli обнаружена также Fe3+-содержащая С. с мол. м. 39 тыс., к-рая
в отличие от др. изоферментов ингибируется NaN3.
Механизм действия С. можно
представить схемой (Е—Сu2+-фермент):
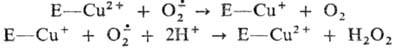
Донором протонов, вероятно,
является имидазольное кольцо остатка гистидина, связывающее ионы металлов. С.,
содержащие Си2+ и Zn2+ , инактивируются Н2О2
из-за образования комплексов ионов этих металлов с ОН.
Ген, ответственный за биосинтез
С., локализован в 21-й хромосоме человека. При трисомии по этой хромосоме (когда
организм содержит 3 гомологич. хромосомы) активность С. в клетках крови увеличена
на 50%. При увеличении парциального давления О2 кол-во С. в организме
увеличивается. Имеются сведения о радиопротекторном действии С.
Изменение активности С.
возникает при нек-рых заболеваниях (напр., атеросклерозе, инфаркте миокарда),
что м. б. использовано для диагностич. целей.
Препараты С. применяют
в качестве противовоспалит. ср-ва, напр. при артритах.
Лит.: Фридович И.,
в кн.: Свободные радикалы в биологии, пер. с англ., т. 1, М., 1979, с. 272-314;
Афанасьев И. Б., "Успехи химии". 1979, т. 48, № 6, с. 977-1014;
его же, в кн.: Кислородные радикалы в химии и биологии, Минск, 1984; с. 13-29;
Ланкин В.З., в кн.: Биохимия липидов и их роль в обмене веществ, М., 1981, с.
75-95. В.З. Ланкин.


