ВИСМУТА ГАЛОГЕНИДЫ. Наиболее изучены тригалогениды BiHal3 (см. табл.). Эти соед. гидролизуются водой (В1Р3 - при кипячении), ее парами и влажным воздухом с образованием оксигалогенидов BiOHal; с галогенидами щелочных металлов и аммония образуют галогенвисмутаты(III): M[BiHal4], M2[BiHal5], а также М[Вi3Наi10] (Hal = F), M3[BiHal6], M3[Bi2Hal9] (Hal = Cl, Br, I). BiHal3 (кроме BiF3) дают аддукты со многими орг. соединениями.
СВОЙСТВА ТРИГАЛОГЕНИДОВ ВИСМУТА

Трифторид BiF3 - бecцв. кристаллы с ромбич. решеткой (а
=
0,65614 нм, Ь = 0,70153 нм, с = 0,48414 нм, z = 4, пространств.
группа Рпта); плохо раств. в воде и фтористоводородной к-те (~ 10-3%
по массе), раств. в муравьиной, пропионовой и молочной к-тах; образует
моногидрат. Получают взаимод. Bi2O3 или Bi(OH)3
с газообразным HF или его водными р-рами. При гидролизе BiF3
при нагр. или сплавлении его с Bi2O3 образуются фазы
состава BiOxF3_2x, к-рые (при 0,02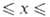 0,17) наряду с M[BiF4] (М = К, Rb) применяют как твердые электролиты
в хим. источниках тока.
0,17) наряду с M[BiF4] (М = К, Rb) применяют как твердые электролиты
в хим. источниках тока.
Трихлорид В1С13 - бесцв., гигроскопичные кристаллы с кубич. решеткой; раств. в неорг. и орг. к-тах, этаноле, ацетоне, эфире; образует моногидрат. Получают взаимод. Bi с С12 выше 200 °С, растворением Bi или Bi2O3 в соляной к-те с послед. упариванием р-ра и перегонкой. Применяют как катализатор гидратации олефинов, присоединения НС1 и хлорорг. соед. к олефинам, замещения с образованием С—С и С—С1 связей.
Трибромид В1Вr3 - лимонно-желтые гигроскопичные кристаллы с моноклинной решеткой; раств. в орг. и неорг. к-тах, ацетоне, жидком NH3; в р-рах присоединяет Вr2, образуя Bi(Br3)3 и Bi(Br5)3. Получают взаимод. Bi с жидким Вr2 или его парами (ок. 250 °С) с послед. перегонкой. Применяют как катализатор присоединения НВг к ненасыщ. орг. соединениям.
Трииодид BiI3 - темно-красные кристаллы с металлич. блеском, решетка гексагональная; хорошо раств. в ацетоне, метаноле и этаноле; в р-рах присоединяет I2, образуя Bi(I3)3. Получают взаимод. Bi с I2 при 150-180°С с послед. перегонкой. Применяют в аналит. химии для определения Cs.
Известен также пентафторид ВiF5 - бесцв. кристаллы, решетка тетрагональная; т. пл. 151 °С, т. кип. 230°С; плотн. 5,4 г/см3; легко гидролизуется; получают взаимод. Bi или BiF3 с F2; сильный фторирующий агент.
Оксигалогениды BiOHal - бесцв. (кроме темно-оранжевого BiOI) кристаллы с тетрагон. решеткой, пространств. группа Р4/nmm, z = 2; не раств. в воде; термически неустойчивы (кроме BiOF).
Оксихлорид BiOCl-т. пл. 232,5°С, т. разл. 575°С; плотн. 7,760 г/см3;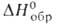 — 367 кДж/моль; раств. в неорг. к-тах. Получают взаимод. р-ра Bi(NO3)3
в разбавл. HNO3 с р-ром NaCl. Применяют как компонент косметич.
ср-в. В природе ВiOС1- минерал бисмоклит.
— 367 кДж/моль; раств. в неорг. к-тах. Получают взаимод. р-ра Bi(NO3)3
в разбавл. HNO3 с р-ром NaCl. Применяют как компонент косметич.
ср-в. В природе ВiOС1- минерал бисмоклит.
Оксибромид BiOBr-т. разл. 560°С; плотн. 8,106 г/см3;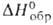 — 297 кДж/моль. Получают взаимод. Bi2O3 с кипящим
разб. р-ром НВr; антисептич. ср-во в ветеринарии. Оксииодид BiOI - т. разл.
300 °С; плотн. 8,013 г/см3. Получают взаимод. р-ра Bi(NO3)3
в ледяной СН3СООН с KI и CH3COONa. Известны также
оксигалогениды др. составов, напр. Bi4O5Cl2,
Bi5O7I.
— 297 кДж/моль. Получают взаимод. Bi2O3 с кипящим
разб. р-ром НВr; антисептич. ср-во в ветеринарии. Оксииодид BiOI - т. разл.
300 °С; плотн. 8,013 г/см3. Получают взаимод. р-ра Bi(NO3)3
в ледяной СН3СООН с KI и CH3COONa. Известны также
оксигалогениды др. составов, напр. Bi4O5Cl2,
Bi5O7I.
В твердом состоянии выделены (Bi9)2[BiCl5]4[Bi2Cl8], Bi6Hal7 (Hal = Cl, Br), содержащие кластерный катион Bi95+ и Bi4Hal4 (Hal = Br, I). Известны газообразные моногалогениды BiHal.
Лит. см. при ст. Висмут Г. В. Зимина, Э. Г. Раков.


