ГИДРОЛАЗЫ, класс ферментов, катализирующих гидролиз. Могут действовать на сложноэфирные и гликозидные связи, на связи С—О в простых эфирах, С—S в сульфидах, С—N в пет идах, и др.
Г., катализирующие гидролиз сложноэфирных связей (эстеразы), действуют на сложные эфиры карбоновых и тио-карбоновых к-т, моноэфиры фосфорной к-ты и др. К этому подклассу относятся, в частности, ферменты, играющие важную роль в метаболизме липидов, нуклеиновых к-т и нуклеозидов, напр. арилсульфатазы, ацетилхолинэстераза, дезоксирибонуклеазы, липазы, фосфатазы, фосфолипазы и эндодезоксирибонуклеазы.
Наиб. группу ферментов, расщепляющих гликозидные связи, представляют те, к-рые катализируют гидролиз олиго- и полисахаридов, напр. амилазы, лизоцим и нейраминидаза. Многие Г. этого подкласса специфичны к положению гликозидной связи и к конфигурации аномерного атома С углевода.
Ферменты, катализирующие гидролиз связи С—N в пептидах и белках (пептидгидролазы),- самая многочисленная группа Г. К ним относятся ферменты, отщепляющие одну или две аминокислоты с N- или С-конца полипептидной цепи (напр., аминопептидазы, карбоксипептидазы), а также эндопептидазы, или протеиназы, расщепляющие цепь вдали от концевых остатков. Последние классифицируют не по специфичности к субстрату, как остальные Г., а по типу каталитически активных групп в активном центре. В соответствии с этим различают сериновые, тиоловые, карбоксильные и металлзависимые протеиназы. Пептидгидролазы играют важную роль не только в катаболизме белков и пептидов, но и в биол. регуляции (гормональной регуляции, активации проферментов, регуляции кровяного давления и солевого обмена и т.д.).
Ферменты, катализирующие гидролиз связей С—N в амидах, амидинах и нитрилах,
играют важную роль в метаболизме амидов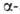 аминокислот
(напр., аспарагина и глутамина), мочевины и ее производных (напр., барбитуратов),
пуринов и пиримидинов и др. К Г. этого подкласса относятся, напр., аспарагиназы
и уреаза.
аминокислот
(напр., аспарагина и глутамина), мочевины и ее производных (напр., барбитуратов),
пуринов и пиримидинов и др. К Г. этого подкласса относятся, напр., аспарагиназы
и уреаза.
Г., расщепляющие связь элемент-кислород в ангидридах неорг. к-т, действуют гл. обр. на фосфоангидридные связи в нуклеозиддифосфатах и нуклеозидтрифосфатах. В эту группу входят, напр., аденозилтрифосфатазы.
Разрыв связи С—С в 3-оксокарбоновых к-тах катализируется, напр., оксалоацетазой, превращающей ацетилщавелевую к-ту в щавелевую и уксусную. Др. подклассы Г. известны своими очень немногочисленными представителями.
Г.-белки с мол. м. от 10-15 тыс. до 200-300 тыс. Они проявляют свою каталитич. активность, как правило, в отсутствие к.-л. кофакторов; лишь в нек-рых случаях необходимы ионы металлов-гл. обр. Zn2+ , Co2+ , Ca2+ , Mg2+ . Для небольшого числа Г. известна первичная, а для нек-рых и пространств. структура молекулы (напр., для лизоци-ма, пепсина, трипсина, химотрипсина). Отмечено значит. сходство структуры ферментов одного подкласса, особенно в области активного центра. Так, мн. протеиназы имеют в активном центре одинаковую последовательность аминокислот: Gly Asp Ser Gly Gly Pro (обозначения см. в ст. Аминокислоты). Близкое строение имеет и активный центр ряда эстераз.
Каталитически активными группами в Г. являются: группа ОН остатка серина в химотрипсине, панкреатич. липазе, щелочной фосфатазе, аспарагиназе и др.; группа SH остатка цистеина, напр. в папаине; группа СООН остатков аспарагиновой и глутаминовой к-т в пепсине, лизоциме, карбоксипептидазе и др.; имидазольная группа остатка гистидина, напр. в рибонуклеазе, глюкозо-6-фосфатазе. Эти группы могут функционировать как нуклеоф. катализаторы, образуя с субстратом ковалентное промежут. соед., или как кислотно-основные катализаторы, способствуя отщеплению протона от молекулы Н2О, атакующей расщепляемую связь, и протонируя уходящую группу субстрата. Атомы металла в металлсодержащих Г. поляризуют расщепляемую связь, включая в свою координац. сферу молекулу Н2О, способствуя ее ионизации. Активность Г. подавляется многими специфич. ингибиторами. Так, сериновые протеиназы и эстеразы инактивируются фосфорорг. соед. (напр., диизопропилфторфосфатом, зарином, зоманом), тиоловые гидролазы - реагентами на SH-группу (напр., N-этилимидом малеиновой к-ты), металлсодержащие ферменты - хелатообразующими реагентами (напр., этилендиаминтетрауксусной к-той).
Г. находят применение в пром-сти, медицине и с. х-ве, напр. для получения сахарных сиропов из крахмала и целлюлозы, осветления и стабилизации соков и виноматериалов, лечения ожогов, заболеваний желудочно-кишечного тракта, тромбозов.
Лит.: Диксон М., Уэбб Э., Ферменты, пер. с англ., т. 1-3, М.,
1982; Антонов В. К., Химия протеолиза, М., 1983; The enzymes, ed. by P.O.
Boyer, 3 ed., v. 3-4, N.Y.-L, 1971; Methods in enzymology, ed. by G.E.
Perfmann, L. Lorand, v. 19, N.Y.-L., ,1970; там же, v. 45, N.Y. 1976.
В. К. Антонов.


