СОЛЬВАТИРОВАННЫЙ ЭЛЕКТРОН,
электрон, захваченный средой в результате поляризации им окружающих молекул
(если средой является вода, электрон наз. гидра-тированным). Образуется при
растворении щелочных металлов в аммиаке, аминах и нек-рых др. жидкостях; фотоионизации
нек-рых чистых жидкостей и мн. в-в, растворенных
в воде, спиртах и т. п.; фотоинжекции электрона из электродов в р-р; радиолизе
воды, спиртов, эфиров, аммиака, аминов, углеводородов и др. жидких и замороженных
систем.
Предлагались разл. теоретич.
модели С. э.; наиб. вероятно, что С.э. является ионным кластером типа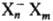 (Х-молекула
р-рителя, n-число молекул в кластере, т-число молекул в ближайших сольватных
слоях), причем h может быть 2, 3, 4, 6 и 8, а m-достигать
больших значений. Возникновение кластеров типа
(Х-молекула
р-рителя, n-число молекул в кластере, т-число молекул в ближайших сольватных
слоях), причем h может быть 2, 3, 4, 6 и 8, а m-достигать
больших значений. Возникновение кластеров типа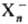 обнаружено методом фотоэлектронной спектроскопии в парах воды, газообразном
аммиаке и т. п.
обнаружено методом фотоэлектронной спектроскопии в парах воды, газообразном
аммиаке и т. п.
Время перехода электрона
из своб. состояния в сольвати-рованное при 295 К составляет (пс): 0,24 в воде,
5 в этилен-гликоле, 11 в метаноле, 18 в этаноле, 51 в деканоле, ~0,2 в аммиаке.
При понижении т-ры это время увеличивается. Переход происходит через стадию
образования локализованного (или предсольватированного) электрона, характеризующегося
меньшей энергией захвата средой. Ра-диац.-хим. выходы С. э. при радиолизе равны:
2,7-2,9 в воде, 1-1,8 в спиртах, 3,1 в аммиаке, 0,1-0,2 в нормальных углеводородах
и до ~ 1 в разветвленных углеводородах.
С. э. характеризуется широкой
интенсивной полосой поглощения в видимой или ЙК области и узкой одиночной линией
(синглетом) в спектре ЭПР. Максимумы оптич. полос поглощения С. э. в воде и
аммиаке соответствуют 720 и 1850 нм, а ширина линий ЭПР в этих жидкостях порядка
миллионных долей Тл. В др. жидкостях максимумы оптич. полос поглощения находятся
(нм): при 560 в этиленгликоле, 625 в метаноле, 680 в этаноле, 650 в деканоле,
2300 в диэти-ловом эфире, 2180 в тетрагидрофуране, 1800 в диоксане, 1920 в метиламине,
1950 в этиламине, 2050 в диэтиламине, 1300 в этилендиамине, 1680 в N,N-диметилформамиде,
2200 в гексаметилфосфортриамиде, 1015 в гидразине, 1580 в трибутилфосфате (при
198 К), 1500
в диметилсульфоксиде,
1500
в диметилсульфоксиде,  1600 в гексане, 730 в расплаве NaCl (при 1073 К) и т.д. В жидкостях С.э. имеет
высокую подвижность. При комнатной т-ре она равна [см2/(В·с)]: 1,92·10-3
в воде, 0,019 в аммиаке, 3,7·10-4 в этаноле, 5,1·10-3
в диэтиловом эфире, 0,8 в диоксане, 0,015 в этиламине, 1,8·10-3 в
этилендиамине, 5,5·10-4 в гексаметаполс, 0,09 в гексане, 70 в неопентане,
0,13 в бензоле.
1600 в гексане, 730 в расплаве NaCl (при 1073 К) и т.д. В жидкостях С.э. имеет
высокую подвижность. При комнатной т-ре она равна [см2/(В·с)]: 1,92·10-3
в воде, 0,019 в аммиаке, 3,7·10-4 в этаноле, 5,1·10-3
в диэтиловом эфире, 0,8 в диоксане, 0,015 в этиламине, 1,8·10-3 в
этилендиамине, 5,5·10-4 в гексаметаполс, 0,09 в гексане, 70 в неопентане,
0,13 в бензоле.
В зависимости от природы
среды и условий образования С.э.-стабильная или короткоживущая частица. В р-рах
щелочных металлов в аммиаке в отсутствие кислорода С. э. может сохраняться месяцами,
тогда как при радиолизе жидкостей макс. время его жизни не превышает тысячных
долей секунды.

С.э.-мощный восстановитель;
в воде его окислит.-вос-становит. потенциал равен —2,87 В. Для С. э. характерны
р-ции трех типов: присоединение к ионам (напр., Cu2+ +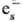 :Cu+;
:Cu+;
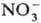 +
+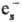 :
: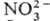 ),
присоединение к нейтральным
молекулам [напр., О2 +
),
присоединение к нейтральным
молекулам [напр., О2 +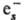 :
: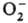 ;
(СН3)2СО
+
;
(СН3)2СО
+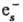 :(СН3)2СО-]
и диссоциативное присоединение (напр., N2O +
:(СН3)2СО-]
и диссоциативное присоединение (напр., N2O +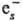 :N2
+ O-; С6Н5СН2Сl +
:N2
+ O-; С6Н5СН2Сl +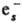 ::
C6H5CH2 + Cl- ). Мн. р-ции С. э.
протекают с высокими скоростями (см. табл.).
::
C6H5CH2 + Cl- ). Мн. р-ции С. э.
протекают с высокими скоростями (см. табл.).
С. э. применяется для получения
ионов металлов в необычных состояниях окисления (напр., Со+, Cd+,
Zn+, Am2+), карбанионов в р-рах (напр.,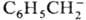 в
тетрагидрофуране)
и др. Его используют для изучения механизма реакций (напр., протекающих
по туннельному механизму; см. Туннельный эффект), реакционной способности
орг. соединений и т.п.
в
тетрагидрофуране)
и др. Его используют для изучения механизма реакций (напр., протекающих
по туннельному механизму; см. Туннельный эффект), реакционной способности
орг. соединений и т.п.
Лит.: Пикаев А. К., Сольватированный электрон в радиационной химии, М., 1969; его же, Современная радиационная химия. Радиолиз газов и жидкостей, М., 1986; Харт Э., Анбар М., Гидратированный электрон, пер. с англ., М., 1973. А. К. Пикаев.


