УБИХИНОНЫ (коферменты
Q; Qn, KoQn, 2,3-диме-токси-5-метил-6-полипренилбензохиноны,
ф-ла I), желтые или желто-оранжевые кристаллы (при n = 7-15) или красные
маслообразные в-ва (n=1-6), не раств. в воде, раств. в орг. р-рителях:
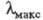 270-275
нм (в зависимости от р-ри-теля). В природе наиб, часто встречаются Q6
- Q10 с Е-конфигура-цией; организму человека свойствен Q10.
У. играют важную роль в биоэнергетике
клетки большинства прокариот и всех эукариот. Осн. ф-ция У.- перенос
электронов и протонов от разл. субстратов к цитохромам при дыхании и
окислительном фосфорилировании.
270-275
нм (в зависимости от р-ри-теля). В природе наиб, часто встречаются Q6
- Q10 с Е-конфигура-цией; организму человека свойствен Q10.
У. играют важную роль в биоэнергетике
клетки большинства прокариот и всех эукариот. Осн. ф-ция У.- перенос
электронов и протонов от разл. субстратов к цитохромам при дыхании и
окислительном фосфорилировании.
У., гл. обр. в восстановленной
форме (убихинолы, QnH2), выполняют ф-цию
антиоксидантов. У. могут быть простетич. группой белков.
Выделены Q-связывающие
белки трех классов, действующие в дыхат. цепи на участках функционирования ферментов
сукцинату-бихинонредуктазы, НАДН-убихинонредуктазы и цитохромов в и с1.
Биосинтез У. включает метаболич.
превращения фенилала-нина, тирозина и др. в 4-гидроксибензойную к-ту (осн. предшественник
ядра У.), построение полипренилпирофосфатной цепи, перенос ее к 4-гидроксибензойной
к-те (либо метаболитам норэпинефрина), последующие р-ции гидроксилирова-ния,
О- и С-метилирования.
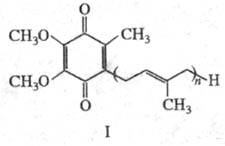
Существуют два осн. пути
хим. синтеза У. Один из них включает алкилирование полипренильной цепью 2,3-диме-токси-5-метил-1,4-гидрохинона
либо его моно- [R(R') = H, R'(R) = AIk, Ac] или диэфиров (R= R'= AIk, Ac) по
р-ции Фриделя - Крафтса, а также регио- и стереоселективное пренилирование бензохинонового
ядра:
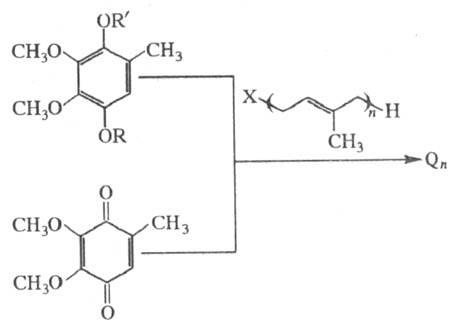
Стереоспецифич. синтез
Q9 и Q10 можно осуществить на основе С45-изопреноидного
спирта - соланезола и получаемого из него декапренола с участием алюмосиликатных
катализаторов в р-ции алкилирования. Соланезол содержится в табаке и нек-рых
др. растениях.
Второй подход к хим. синтезу
У. состоит в наращивании по терминальному звену полипренильной цепи низшего
прир. гомолога или синтетического У. в окисленной форме либо в виде диэфира
QnH2 на недостающий пренильныи фрагмент с помощью разл.
р-ций С - С-сочетания:
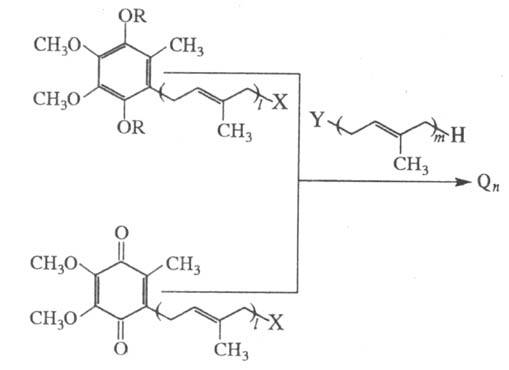
X=Cl, Br, C6H5SO2,
CH3C6H4SO2; Y=CH3C6H4SO2,
C6H5SO2, Br, Cl; R=AIk, Ac; l+т=п
Для пром. целей У. целесообразно
выделять из биомассы микроорганизмов (бактерии, дрожжи, грибы и др.); разработаны
эффективные биотехнол. методы произ-ва Q9 и Q10.
Количественно У. определяют
спектрофотометрически по различию абсорбции-окисленной и восстановленной форм
при 275 нм в р-ре этанола, методом высокоэффективной жидкостной хроматографии
и др. методами; для идентификации гомологов У. используют тонкослойную хроматографию
с обращенной фазой, ЯМР и масс-спектрометрию. В УФ спектре для У. характерно
смещение максимума поглощения от 275 нм (этанол) к 290 нм при добавлении NaBH4
и изменение уд. показателя поглощения приблизительно в 3 раза.
Препараты У. применяют
для лечения заболеваний сердечно-сосудистой системы (в т. ч. хронических), лечения
детей с митральным пороком сердца, для уменьшения кардиоток-сич. действия противоопухолевых
антибиотиков и в качестве иммуномодулирующих ср-в.
Лит.: Обольникова
E. А.,в кн.: Коферменты, под ред. В. А. Яковлева, M., 1973, с. 117-32; Коган
Л.М., Обольникова Е.А., Самохвалов Г. И., "Хим.-фарм. журнал", 1983,
т. 17, № 4, с. 410-20; Моисеен-ков A.M. [и др.], "Изв. АН СССР. Сер. хим.",
1989, № 7, с. 1612-15; Coenzyme Q., ed. by G. Lenaz, Chichester, 1985; Biomedical
and clinical aspects of coenzyme Q, ed. by K. Folkers, Y. Yamamura, v. 1-5,
Amst., 1977-86.
E. А. Обольникова.


