АЛЛЕНЫ (1,2-диены), соединения общей ф-лы RR'C=C=CR"R'", где
R, R', R", R'"-H, Alk, Аг, остаток гетероцикла или к.-л. функц. группа.
Первый член ряда- аллен СН2=С=СН2: бесцв. газ; т.пл.
-136,2°С, т.кип. -34,5°С; КПВ 1,7-10%.
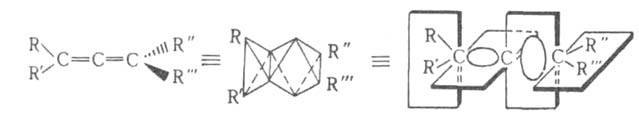
Структурные модели хирального аллена.
Квантовомех. модель кумулированных двойных связей в А. предусматривает
sp2-электронное состояние для обоих крайних атомов С. Центр.
атом С имеет sp-гибридизацию. Поэтому вся исходящая от него система связей
линейна; обе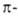 связи
и концевые заместители расположены во взаимно перпендикулярных плоскостях
(см. рис.). Вследствие этого взаимное влияние заместителей минимально,
а при несимметричном замещении А. существуют в виде энантиомеров. Это положение
было предсказано еще Я. Вант-Гоффом; впоследствии оно было подтверждено
расщеплением А. на оптич. антиподы, синтезом оптически активных А. с использованием
хиральных реагентов или оптически активных исходных соединений, напр.:
связи
и концевые заместители расположены во взаимно перпендикулярных плоскостях
(см. рис.). Вследствие этого взаимное влияние заместителей минимально,
а при несимметричном замещении А. существуют в виде энантиомеров. Это положение
было предсказано еще Я. Вант-Гоффом; впоследствии оно было подтверждено
расщеплением А. на оптич. антиподы, синтезом оптически активных А. с использованием
хиральных реагентов или оптически активных исходных соединений, напр.:
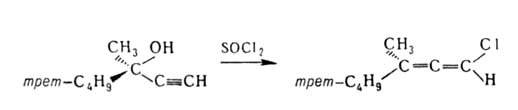
Электроф. и радикальное присоединения к А. происходят легче, чем к олефинам,
из-за наличия двух соседних связей С=С; при этом образуются винильные или
аллильные структуры, напр.:
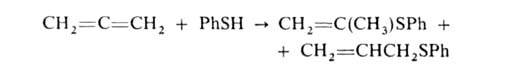
Под действием к-т или щелочей алленовая связь может перейти в ацетиленовую
или 1,3-диеновую (прототропная изомеризация):
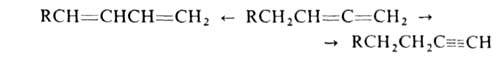
А. способны полимеризоваться с образованием смеси гомологов (от ди-
до гексамеров); при димеризации получаются производные циклобутана. А.
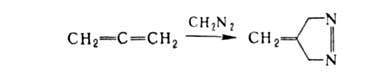
вступают в циклопри-соединение и с др. соед., имеющими кратные связи, напр.:
Алленовые группировки, сопряженные с электроноакцепторными группами,
легко присоединяют по кратной связи нуклеофилы (YH):
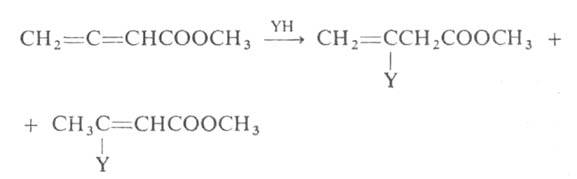
Важнейшие способы получения А.:
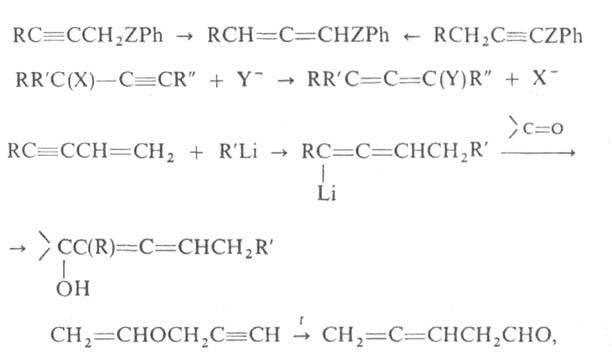
где X и Y-OH, Hal, OSO2R'"; Z = О, S, Se.
Кроме того, А. можно синтезировать теми же способами, что и соединения
с одной двойной связью: дегалогенированием, дегидрогалогенированием, дегидратацией,
а также пиролизом енолфосфатов:
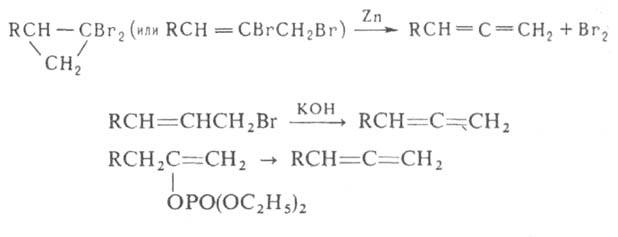
А. широко применяют в орг. синтезе. Они являются промежут. продуктами при получении простагландинов, феромонов, витаминов, лек. препаратов и др. А. обнаружены среди метаболитов низших грибов, высших растений, а также продуктов жизнедеятельности морских гидробионтов и насекомых.
Лит.. МавровМ. В., Кучеров В. Ф., в кн.. Реакции и методы исследования
органических соединений, кн. 21, М., 1970, с. 90-316; Кучеров В. Ф., Мавров
М.В., Держинский А. Р.. Природные полиацетиленовые соединения, М., 1972,
гл. 5;Табер А. М., Калечиц И. В., Аллен, М., 1975; Мавров М. В., "Успехи
химии", 1982, т. 51, в. 9, с. 1541-66: The chemistry of ketenes, allenes
and related compounds, ed. S. Patai, v. 1-2, N. Y., 1980. М. В. Мавров.


