ВОЛЬФРАМА ОКСИДЫ. В системе W-O (см. рис.) установлен состав
четырех оксидов: триоксида WO3; промежут. оксидов W20O58,
или WO2 90 (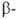 оксид),
и W18O49, или WO2 72 (
оксид),
и W18O49, или WO2 72 (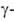 оксид);
диоксида WO2 (
оксид);
диоксида WO2 (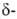 оксид).
Структура В. о. построена из различно сочлененных октаэдрич. группировок
WO6. Св-ва В. о. приведены в табл.
оксид).
Структура В. о. построена из различно сочлененных октаэдрич. группировок
WO6. Св-ва В. о. приведены в табл.
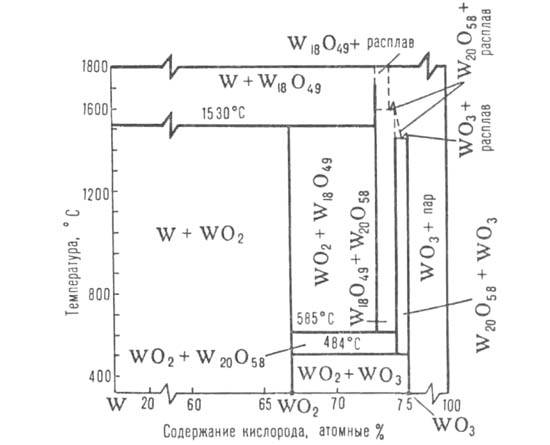
Фазовая диаграмма системы вольфрам - кислород. Пунктирными линиями обозначены приблизительные области сосуществования твердой и жидкой фаз для WO3, W20O58 и Wi8O49
СВОЙСТВА ОКСИДОВ ВОЛЬФРАМА
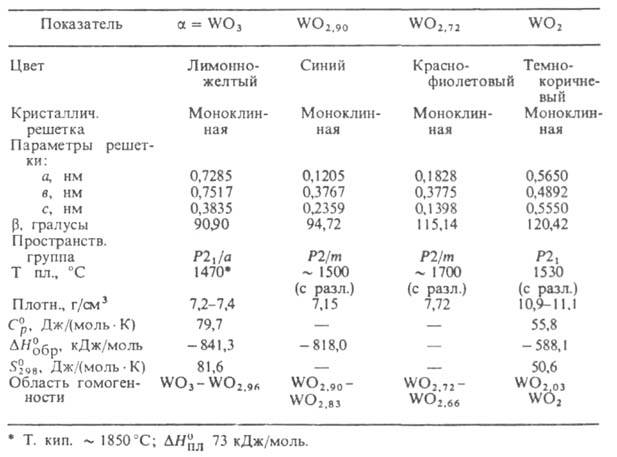
Триоксид WO3. До — 27°С устойчива моноклинная модификация,
в интервале от —27° до 20°С - триклинная, при 20-339 °С- моноклинная I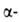 WO3),
при 339-740 °С - ромбическая, при 740-1470 °С- тетрагональная. Заметно
возгоняется выше 800 °С. В газовой фазе существует в виде ди-, три- и тетрамеров.
Практически не раств. в воде (0,02 г/л) и минер. к-тах (за исключением
HF). Образует гидрат WO3*Н2О-вольфрамовую к-ту (см.
Вольфраматы). С р-рами щелочей, Na2CO3, а
также NH3 (при нагр.) взаимод. с образованием вольфраматов.
Восстанавливается до металла водородом при 700-900°С, углеродом - выше
1000°С. Получают термич. разложением вольфрамовой к-ты или (NH4)10[H2W12O42]*4H20
при 500-800°С, а также окислением W на воздухе выше 500°С. WO3 -
промежут. продукт в произ-ве вольфрама. Его используют для получения карбидов
и галогенидов W, вольфраматов, как пигмент для окрашивания керамич. и стеклянных
изделий в желтый цвет, катализатор гидрогенизации и крекинга углеводородов.
WO3),
при 339-740 °С - ромбическая, при 740-1470 °С- тетрагональная. Заметно
возгоняется выше 800 °С. В газовой фазе существует в виде ди-, три- и тетрамеров.
Практически не раств. в воде (0,02 г/л) и минер. к-тах (за исключением
HF). Образует гидрат WO3*Н2О-вольфрамовую к-ту (см.
Вольфраматы). С р-рами щелочей, Na2CO3, а
также NH3 (при нагр.) взаимод. с образованием вольфраматов.
Восстанавливается до металла водородом при 700-900°С, углеродом - выше
1000°С. Получают термич. разложением вольфрамовой к-ты или (NH4)10[H2W12O42]*4H20
при 500-800°С, а также окислением W на воздухе выше 500°С. WO3 -
промежут. продукт в произ-ве вольфрама. Его используют для получения карбидов
и галогенидов W, вольфраматов, как пигмент для окрашивания керамич. и стеклянных
изделий в желтый цвет, катализатор гидрогенизации и крекинга углеводородов.
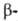 Оксид WO29
устойчив в интервале 485-1500 °С; ниже 485 °С диспропорционирует с образованием
WO2 и WO3.
Оксид WO29
устойчив в интервале 485-1500 °С; ниже 485 °С диспропорционирует с образованием
WO2 и WO3.
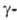 Оксид WO2,72
устойчив в интервале 585-1700°С; ниже 585 °С диспропорционирует с образованием
WO2 и WO2 90.
Оксид WO2,72
устойчив в интервале 585-1700°С; ниже 585 °С диспропорционирует с образованием
WO2 и WO2 90.
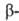 и
и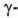 Оксиды
мало раств. в воде, соляной к-те и разб. H2SO4; окисляются
HNO3. Обладают полупроводниковыми св-вами. Образуются при восстановлении
WO3 водородом в присут. паров воды при 300-600 °С. М. б. также
получены при длит. нагревании в интервале 700-900 °С стехио-метрич. смесей
WO3 с W или WO3 с WO2 в атмосфере Аг или
N2.
Оксиды
мало раств. в воде, соляной к-те и разб. H2SO4; окисляются
HNO3. Обладают полупроводниковыми св-вами. Образуются при восстановлении
WO3 водородом в присут. паров воды при 300-600 °С. М. б. также
получены при длит. нагревании в интервале 700-900 °С стехио-метрич. смесей
WO3 с W или WO3 с WO2 в атмосфере Аг или
N2.
Диоксид WO2 (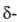 оксид)
при т-ре 1530°С плавится с разложением на W и WO2,72. Диспропорционирует
в твердой фазе при 900-1000 °С с образованием W и паров WO3.
He раств. в воде, соляной к-те и разб. H2SO4, окисляется
HNO3. Получают восстановлением WO3 водородом при
575-600 SC
оксид)
при т-ре 1530°С плавится с разложением на W и WO2,72. Диспропорционирует
в твердой фазе при 900-1000 °С с образованием W и паров WO3.
He раств. в воде, соляной к-те и разб. H2SO4, окисляется
HNO3. Получают восстановлением WO3 водородом при
575-600 SC
Лит. см. при ст. Вольфрам. А. Н. Зеликман.


