Обычно Г. осуществляют в условиях гетерог. или гомог. катализа. В пром-сти Наиб. распространено гетерогенное Г. молекулярным водородом. При этом Н2, активированный катализатором, ступенчато присоединяется к субстрату; стадией, лимитирующей скорость Г., обычно является перенос водорода на субстрат. Катализаторы-хим. элементы с недостроенными d-оболочками, чаще всего металлы VIII гр. периодической системы, оксиды и сульфиды металлов, а также многокомпонентные катализаторы.
При гетерог. Г. увеличение числа и объема заместителей при кратной связи
приводит к затруднению координации соед. с пов-стью катализатора и доступа
к нему Н2. Скорость Г. часто определяется природой гидрируемой
связи. Достаточно легко гидрируются ацетилены, олефины, нитросоединения,
труднее-ароматич. углеводороды, альдегиды, кетоны, карбоновые к-ты и их
производные (см. табл.). Недостаток процесса-невысокая селективность вследствие
протекания побочных р-ций крекинга, гидрогенолиза и т.п.
УСЛОВИЯ КАТАЛИТИЧЕСКОГО ГИДРИРОВАНИЯ РАЗЛИЧНЫХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
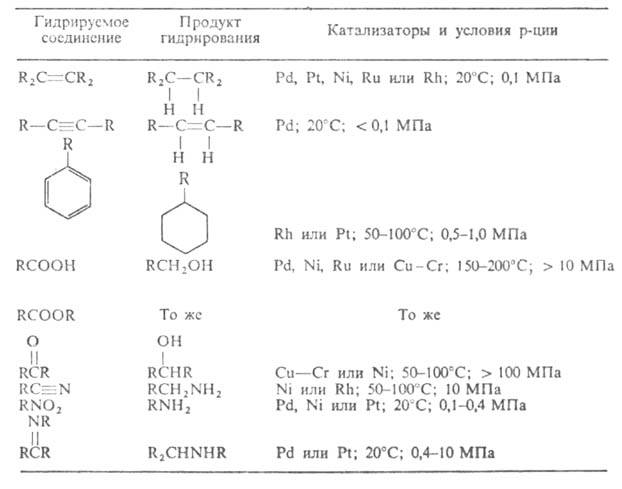
Каталитич. гетерог. Г.-один из важнейших процессов хим. пром-сти. См., напр., Гидроочистка, Гидрокрекинг, Гидрогенизация жиров и др.
При гомогенном Г. активация водорода и субстрата происходит путем их
включения в координац. сферу каталитич. комплекса. При этом идет гетеролитич.
или гомолитич. диссоциация водорода, что и создает условия для Г. Связь
субстрата с атомом металла катализатора должна быть достаточно лабильной.
Алкены, образующие слишком прочные связи, не гидрируются в этих условиях.
В кач-ве катализаторов используют соед. переходных металлов: соли, карбонилы,
фосфиновые комплексы, двухкомпонентные системы, получаемые взаимод. солей
с восстановителями или комплексообразователями (напр., катализаторы Циглера-Натты).
Вследствие большей активности катализаторов и соотв. более мягких условий
гомог. Г. обычно более избирательно, чем гетерогенное. Важная область применения
таких процессов-синтез оптически активных в-в, напр. Г. фенилакриловой
к-ты, катализируемое комплексами RhCl3 с фосфинами и проводимое
в смеси бензол-этанол.
фенилакриловой
к-ты, катализируемое комплексами RhCl3 с фосфинами и проводимое
в смеси бензол-этанол.
В орг. синтезе широко используется некаталитич. гомог. Г. Доноры водорода в этом случае - металлы в спиртах, к-тах, аммиаке и аминах; комплексные гидриды металлов (напр., Na[BH4], Li[AlH4]), бораны. При некаталитич. Г. первоначально идет атака нуклеоф. агента (электрона или гидрид-иона) по месту наименьшей электронной плотности в молекуле ненасыщ. соед. с послед. присоединением протона. При этом поляризованные двойные связи гидрируются легче неполяризованных.
Электроф. ионное Г. основано на способности гидрируемого соед. присоединять протон с образованием активного промежут. иона карбения, к-рый в свою очередь отрывает гидрид-ион от подходящего донора. Обычно донорами протонов служат сильные к-ты, напр. трифторуксусная, донорами гидрид-ионов - триалкилсиланы, жирно-ароматич. или неполностью гидрированные ароматич. углеводороды. Ионное Г. используют для восстановления нек-рых гетероциклич. соед.-производных тиофена, фурана, индола, для получения соед., меченных дейтерием,
Лит.: Жсрмен Д.-Э., Каталитические превращения углеводородов,
пер. с англ., М., 1972; Джеймс Б., Гомогенное гидрирование, пер. с англ.,
М., 1976; Ионное гидрирование, М., 1979; Лебедев Н. Н., Химия и технология
основного органического и нефтехимического синтеза, 3 изд., М., 1981; Гейтс
Б. К., Кетцир Дж., Шуйт Г., Химия каталитических процессов, пер. с англ.,
М., 1981. А. В. Анисимов.


