ГИДРОГАЛОГЕНИРОВАНИЕ, присоединение галогено-водородов по кратным
связям орг. соед., напр.:
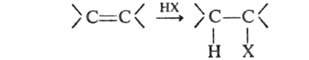
Реакц. способность галогеноводородов возрастает в ряду: HF < НС1 < НВг < HI.
Г. протекает по гетеролитич. механизму, при к-ром водород присоединяется
к Наиб. гидрогенизированному атому углерода (Марковникова правило).
В случае несимметричных олефинов происходит образование вторичных или
третичных алкилгалогенидов, напр.:
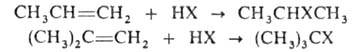
Реакц. способность олефина повышается при введении в его молекулу электронодонорных
групп и понижается при введении электроноакцепторных в след. ряду:
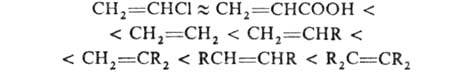
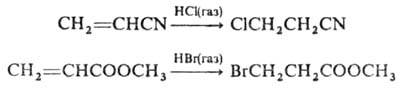
Присоединение галогеноводородов к связям С=С, сопряженным с электроноакцепторными
группами, напр. С=О, COOR, CN, протекает медленнее, чем в случае изолированных
связей. Атом галогена присоединяется в положение к электроноакцепторной
группе: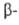
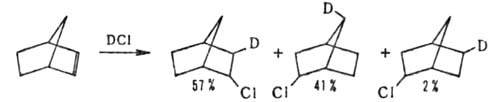
Поскольку при Г. образуется промежут. карбкатион, в ходе р-ции возможно
образование изомерных продуктов, напр.:
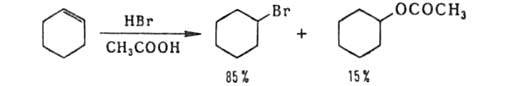
В среде нуклеоф. р-рителей возможна конкурирующая р-ция с р-рителем,
напр.:
В присут. инициаторов радикальных р-ций Г. идет по го-молитич. механизму
против правила Марковникова (эффект Караша), напр.:
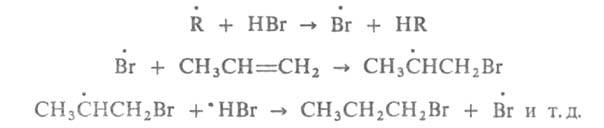
Г. широко применяется в орг. синтезе. При гидрофторировании хлорированных
олефинов р-цию проводят в автоклаве:
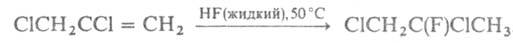
Обычно гидрохлорирование и гидрооромирование в газовой фазе проводят,
пропуская газообразные галогеноводороды в жидкий олефин при — 20 °С; при
Г. в жидкой фазе р-цию ведут при 0-15°С в ледяной СН3СООН. При
взаимод. в газовой фазе смесь олефина и HHal пропускают через нагретую
трубку с катализатором (А1С13, А1Вr3, BiCl3,
BiBr3, ZnCl2, HgCl2). Присоединение HI
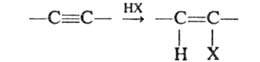
осуществляют действием иодидов щелочных металлов в кислой среде. Г. алкинов
используют для получения гем-дигалогенуглеводородов:
В пром-сти Г. используют для синтеза хлорсодержащих р-рителей и мономеров.
Лит.: Матьё Ж., Панико Р., Вейль-Рейналь Ж., Изменение и введение функций в органическом синтезе, пер. с франц., М., 1980, а 136-38; Гауптман 3., Грефе Ю, Рема не X., Органическая химия, пер. с нем., М., 1979, с. 225-34
 ГИДРОГЕКСАФТОРИЗОМАСЛЯНАЯ
КИСЛОТА (2-трифторметил-3,3,3-трифторпропионовая к-та;
ГИДРОГЕКСАФТОРИЗОМАСЛЯНАЯ
КИСЛОТА (2-трифторметил-3,3,3-трифторпропионовая к-та; гидро-перфторизомасляная
к-та) (CF3)2CHCOOH, мол. м. 196,05; бесцв. гигроскопичные
кристаллы с резким запахом; т. пл. 49-50°С, т. кип. 128°С/748 мм рт. ст,
95°С/200 мм рт. ст.; хорошо раств. в эфире, ацетоне, диоксане, хуже-в воде
(рКа 2,35). Для метилового эфира ЛД50 300
мг/кг (мыши, перорально). Дегидратация
гидро-перфторизомасляная
к-та) (CF3)2CHCOOH, мол. м. 196,05; бесцв. гигроскопичные
кристаллы с резким запахом; т. пл. 49-50°С, т. кип. 128°С/748 мм рт. ст,
95°С/200 мм рт. ст.; хорошо раств. в эфире, ацетоне, диоксане, хуже-в воде
(рКа 2,35). Для метилового эфира ЛД50 300
мг/кг (мыши, перорально). Дегидратация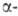 Г.к.
при помощи Р2О5 приводит к устойчивому бис-(трифторметил)
кетену (CF3)2C—С=О, декарбоксилирование в присут.
(C2H5)3N-к 1,1,1,3,3,3-гексафторпропану
(CF3)2CH2. К-Соль
Г.к.
при помощи Р2О5 приводит к устойчивому бис-(трифторметил)
кетену (CF3)2C—С=О, декарбоксилирование в присут.
(C2H5)3N-к 1,1,1,3,3,3-гексафторпропану
(CF3)2CH2. К-Соль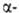 Г.
к. превращается при ~80°С в 1,1,3,3,3-пентафторпропен CF3CH=CF2.
При дегидрофторировании эфиров
Г.
к. превращается при ~80°С в 1,1,3,3,3-пентафторпропен CF3CH=CF2.
При дегидрофторировании эфиров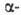 Г.
к. образуются эфиры перфторметакриловой к-ты CF2= =C(CF3)COOR.
Получают
Г.
к. образуются эфиры перфторметакриловой к-ты CF2= =C(CF3)COOR.
Получают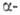 Г.
к. гидратацией перфтор-изобутилена (CF3)2C=CF2
в орг. р-рителе. Применяют в лаб. практике для синтеза эфиров и (CF3)2C=C=O.
Г.
к. гидратацией перфтор-изобутилена (CF3)2C=CF2
в орг. р-рителе. Применяют в лаб. практике для синтеза эфиров и (CF3)2C=C=O.


