Хлорноватистая к-та НС1О (мол. м. 52,4603)-сла-бая одноосновная к-та
(рКа 7,537). Существует в водных р-рах (макс. концентрация
~ 30%) и в газообразном состоянии. Длина связи С1—О в молекуле Н—О—С1 0,1689
нм, связи Н—О 0,0974 нм, угол НОС1 104°. Для газа: Сp° 37,284
Дж/(моль*К);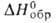 - 90 кДж/моль,
- 90 кДж/моль,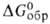 - 71 кДж/моль; Sо298 236,474 Дж/(моль*К);-для бесконечно
разб. водного р-ра
- 71 кДж/моль; Sо298 236,474 Дж/(моль*К);-для бесконечно
разб. водного р-ра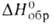 -124,7 кДж/моль. Для водного р-ра НС1О характерны равновесия: НСlO
-124,7 кДж/моль. Для водного р-ра НС1О характерны равновесия: НСlO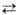 Н+
+ ОСl- и 2НС1О
Н+
+ ОСl- и 2НС1О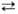 С12О
+ Н2О. В р-ре с расчетной концентрацией НСЮ 4 моль/л фактич.
концентрация НСlO 3,606, СlO-3,7*10-4, С12О
1,93*10-1 моль/л; рН 3,43. По мере разбавления р-ра содержание
С1О~ и С12О убывает, рН возрастает, а фактич. концентрация НСЮ
приближается к расчетной. Парциальное давление НСЮ над 0,1 м водным р-ром
230 Па.
С12О
+ Н2О. В р-ре с расчетной концентрацией НСЮ 4 моль/л фактич.
концентрация НСlO 3,606, СlO-3,7*10-4, С12О
1,93*10-1 моль/л; рН 3,43. По мере разбавления р-ра содержание
С1О~ и С12О убывает, рН возрастает, а фактич. концентрация НСЮ
приближается к расчетной. Парциальное давление НСЮ над 0,1 м водным р-ром
230 Па.
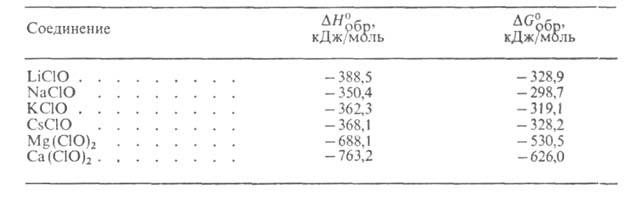
Г. металлов (ионные Г.), за исключением кальция гипохлорита-неустойчивые соединения. В своб. виде почти не исследованы; большинство выделено только в виде кристаллогидратов, многие существуют лишь в водных р-рах. Г. щелочных и щел.-зем. металлов хорошо раств. в воде (г в 100 г): LiCIO 72 (20°С), NaCIO 53,4 (20°С), Са(С1О)2 33,3 (25oС). LiCIO кристаллизуется в виде моногидрата, NaCIO образует гидраты с 5 (т. пл. 24,5°С) и 2,5 молекулами Н2О (т. пл. 57,5е С). Для Са(С1О)2 известны три-, ди- и моногидраты. В безводном состоянии ионные Г. нестабильны и взрывчаты. Гидраты более устойчивы, но все же в обычных условиях самопроизвольно распадаются. Напр., LiCIO*H2O теряет 2% активного хлора (кол-во хлора, выделяющегося при взаимод. с соляной к-той) за 53 сут, NaCIO*5Н2О-30% за 40 сут. Термодинамич. св-ва водных р-ров Г. металлов приведены в таблице.
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ГИПОХЛОРИТОВ В БЕСКОНЕЧНО РАЗБАВЛЕННОМ
ВОДНОМ РАСТВОРЕ
Скорость и направление распада НСЮ и ионных Г. в водных р-рах зависят от рН, т-ры, концентрации, наличия примесей и освещения. В очень кислой среде (рН < 3) при комнатной т-ре происходит медленный распад:
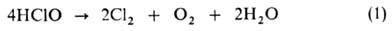
Если для подкисления использована соляная к-та, наблюдается быстрая р-ция, равновесие к-рой сдвинуто вправо:
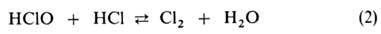
В интервале рН 3,0-7,5 идет автокаталитич. процесс:
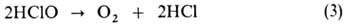
Освещение ускоряет р-цию (3), причем видимый свет оказывает более сильное влияние, чем ультрафиолетовый. При рН 6-8, когда в р-ре присутствуют НСЮ и С1О-в соизмеримых кол-вах, идет диспропорционирование:
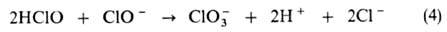
До 70 °С вклад этой р-ции невелик, однако при более высоких т-рах она становится преобладающей. Введение в р-р ионов переходных металлов, напр. Со2+, Ni2+, Сu2+, существенно ускоряет р-цию (3), причем повышение рН ослабляет каталитич. действие. Из соед. платиновых металлов каталитич. действие оказывают только соед. Ir, направляющие распад по пути (4). Р-ции (1)-(3) в значит. степени определяют дезинфицирующие и отбеливающие св-ва Г.
Г. в водном р-ре - сильные окислители. При рН 4
они окисляют I- до I2, при рН 5-7-до IO3,
при рН>7-до IO4. Нитриты в водных р-рах окисляются до нитратов,
соли гидразония - до N2, С1О2 - до C1OJ (в нейтральной
среде), SO32--до SО42-, CN--до
OCN-, МnО42--ДО МnО4-и
др. Формиаты и оксалаты окисляются до карбонатов.
4
они окисляют I- до I2, при рН 5-7-до IO3,
при рН>7-до IO4. Нитриты в водных р-рах окисляются до нитратов,
соли гидразония - до N2, С1О2 - до C1OJ (в нейтральной
среде), SO32--до SО42-, CN--до
OCN-, МnО42--ДО МnО4-и
др. Формиаты и оксалаты окисляются до карбонатов.
Наиб. изученные ковалентные Г.-трифторметилгипохлорит СF3ОС1 (т. пл. - 142°С, т. кип. -46°С); пентафторгипохлорит серы SF5OC1 (т. кип. 9°С); фторосульфурилгипохлорит SO2FOC1 (т. кип. 43,4°С); нитрилгипохлорит NO2OC1 (т. пл. - 107°С, т. кип. -22°С); перхлорилгипохлорит СlO3ОС1 (т. пл. -117°С, т. кип. 44,5°С). Все они очень гигроскопичные летучие в-ва, разлагающиеся при 40-100 °С. Под действием озона С1О3ОС1 окисляется до (СlO2)+(С1О4)-, NO2OCl-до (NO2)+(C104)-, SO2FOC1-до (C1O2)+(SO3F)-.
При взаимод. ионных и ковалентных Г. с Н2О2 в
щелочном р-ре (ОСl- + Н2О2 -> Н2О
+ Сl- + О2) кислород выделяется не в обычном триплетном
состоянии, а в возбужденном синглетном; энергия возбуждения составляет
0,98 эВ. Генерируемый таким способом синглетный -кислород
используют в мощных хим. лазерах непрерывного действия для передачи энергии
возбуждения атомам иода.
-кислород
используют в мощных хим. лазерах непрерывного действия для передачи энергии
возбуждения атомам иода.
Г. кальция, натрия и лития производят в пром. масштабе взаимод. газообразного С12 с р-ром или суспензией соответствующего гидроксида с послед. выделением кристаллизацией. Выпускают в виде кристаллогидратов, основных солей и водных р-ров. Лаб. способы получения: НСlO — пропускание С12 через суспензию HgO или Bi2O3 в воде, а также гидролиз С12О; Г.-нейтрализация р-ра НСlO. Большинство ковалентных Г. получают действием C1F на соответствующие безводные к-ты или оксиды.
Р-ры ионных Г. применяют для отбеливания тканей, бумаги и целлюлозы, дегазации ВВ, как дезинфицирующие ср-ва (в т.ч. для обеззараживания сточных вод), а также в орг. синтезе при получении СНС13, хлорпикрина и др. См. также Хлорная известь.
Лит.: Фурман А.А., Хлорсодержашие окислительно-отбеливающие и
дезинфицирующие вещества, М., 1976.


