ГЛУТАМАТСИНТАЗА, фермент класса оксидоредуктаз, катализирующий
образование L-глутаминовой к-ты из L-глутамина и 2-оксоглутаровой к-ты:
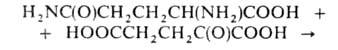
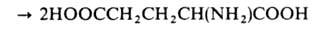
Коферментами Г. могут быть никотинамидадениндину-клеотидфосфат или никотинамидадениндинуклеотид (мол. масса фермента 200-800 тыс.) и ферредоксин (мол. м. 145-250 тыс.).
Четвертичная структура Г. первого типа характеризуется наличием неодинаковых субъединиц; молекула содержит флавин, негиминовое железо и серу со степенью окисления — 2. Г. второго типа либо не имеет четвертичной структуры, либо состоит из идентичных субъединиц. Каталитич. активность Г. проявляется при рН 7-8. Фермент абсолютно специфичен по отношению к субстратам. Ингибиторы Г.-азасерин, гомоцистеинсульфонамид и метионинсульфон.
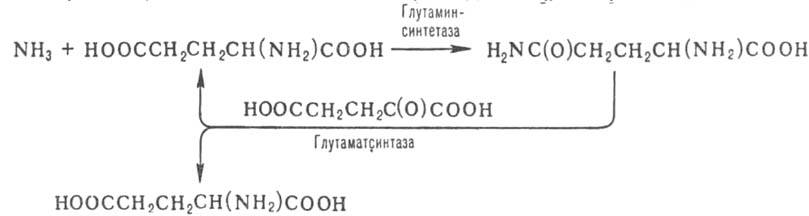
Г. содержится в растениях и микроорганизмах. В совокупности с глутаминсинтетазой
обеспечивает включение осн. массы азота (в виде NН3) в орг.
соед. по схеме:
Лит.: Молекулярные механизмы усвоения азота растениями,
М., 1983, с. 198-234; Tempest D. W., Meers Y. L., Brown С. М., в кн.: The
enzymes of glutamine metabolism, N.Y.-L., 1973, p. 167-82; Saka H., Voqui-Dinh
Т.Н., Cheng T.-Y., "Plant. Science Letters", 1980, v. 19, № 3, p. 193-201;
Suzuki A., Gadal P., "Physiologic vegetale", 1984, v. 22, № 4, p. 471-86.
A.B. Пушкин.
 ГЛУТАМИЛТРАНСФЕРАЗА
[(5-глутамил)пептид : аминокислота 5-глутамилтрансфераза], фермент класса
транс-фераз, катализирующий перенос остатка глутаминовой к-ты на какой-либо
акцептор:
ГЛУТАМИЛТРАНСФЕРАЗА
[(5-глутамил)пептид : аминокислота 5-глутамилтрансфераза], фермент класса
транс-фераз, катализирующий перенос остатка глутаминовой к-ты на какой-либо
акцептор:
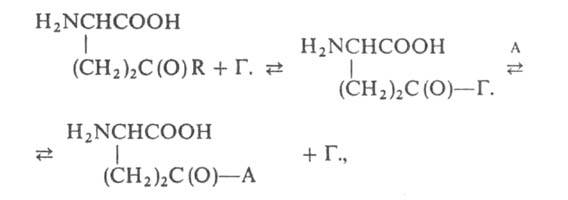
где R-остаток аминокислоты, пептида или группа ОН; А-акцептор остатка
глутаминовой к-ты (гл. обр. кодируемая аминокислота,
а также нек-рые дипептиды, Н2О, NH2OH). Специфичность
Г. к акцепторам значительно варьирует у разл. организмов. У млекопитающих
наиб. сродством к ферменту обладают глицилглицин, L-цистин, L-глутамин
и L-метионин. К пролину Г. абсолютно неспецифична.
аминокислота,
а также нек-рые дипептиды, Н2О, NH2OH). Специфичность
Г. к акцепторам значительно варьирует у разл. организмов. У млекопитающих
наиб. сродством к ферменту обладают глицилглицин, L-цистин, L-глутамин
и L-метионин. К пролину Г. абсолютно неспецифична.
В организме Г. ответствен за биосинтез глутамилпеп-тидов
и, возможно, за их перенос через клеточную мембрану в т. наз.
глутамилпеп-тидов
и, возможно, за их перенос через клеточную мембрану в т. наз. глутамильном
цикле. Он также участвует в деградации глутатиона (больные с врожденной
недостаточностью Г. обнаруживают глутатионемию и глутатионурию) и играет
роль в реакциях детоксикации.
глутамильном
цикле. Он также участвует в деградации глутатиона (больные с врожденной
недостаточностью Г. обнаруживают глутатионемию и глутатионурию) и играет
роль в реакциях детоксикации.
Г.-гликопротеид. Существует в двух формах (мол. м. 200 тыс. и 68-92
тыс.), молекулы к-рых состоят из двух субъединиц. На одной из них (с меньшей
мол. массой) расположен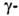 глутамилсвязывающий
участок, другая участвует в связывании фермента с мембранами клетки. Оптим.
каталитич. активность Г. проявляется обычно при рН 8,2, при переносе остатка
глутаминовой к-ты на Н2О - ниже рН 7.
глутамилсвязывающий
участок, другая участвует в связывании фермента с мембранами клетки. Оптим.
каталитич. активность Г. проявляется обычно при рН 8,2, при переносе остатка
глутаминовой к-ты на Н2О - ниже рН 7.
Г. может ингибироваться необратимо, напр. 6-диазо-5-окco-L-норлейцином,
и обратимо, напр. серином в присут. солей борной к-ты,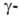 глутамилгидразонами
глутамилгидразонами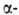 кетокислот
и
кетокислот
и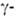 глутамилфенилгидразидами.
Представители двух последних групп в-в ингибируют Г. по конкурентному механизму
(т.е. вытесняют субстрат из фермент-субстратного комплекса).
глутамилфенилгидразидами.
Представители двух последних групп в-в ингибируют Г. по конкурентному механизму
(т.е. вытесняют субстрат из фермент-субстратного комплекса).
Г. содержится в тканях животных (гл. обр. в почках) и растений. В пределах одного класса животных она иммунологически однородна и отличается только составом небелковой компоненты. При нек-рых заболеваниях печени и поджелудочной железы активность Г. в сыворотке крови повышается, что используется в диагностич. целях.
Лит.: Горленко В. А., Филиппович Ю. Б., "Успехи современной биологии", 1979, т. 88, в. 3 (6), с. 367-86; Tate S. S., Meister A., "Molecular and Cellular Biochemistry", 1981, v. 39, p. 357-68. В. А. Горленко.


