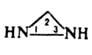
Благодаря высокой устойчивости пирамидальной конфигурации атомов N, N-алкилдиазиридины получены в оптически активной форме. Производные Д., содержащие в кольце хотя бы одну незамещенную группу NH, вступают в р-цию Манниха по этой группе, дают устойчивые аддукты с хлоралем, формальдегидом, ацилируются ацилгалогенидами, изоцианатами, восстанавливаются на никеле Ренея или под действием LiAlH4 с разрывом связи N—N, напр.:
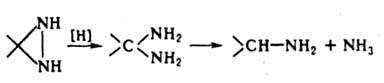
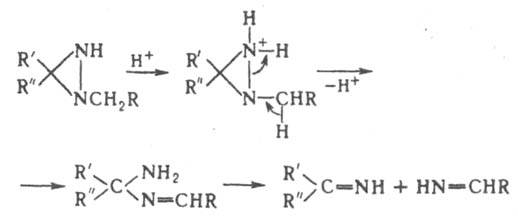
1-Ацилдиазиридины легко перегруппировываются в гидразоны. При кислотном гидролизе Д. и мн. его производных образуются гидразины; к-ты в апротонных р-рителях вызывают раскрытие цикла по связи N—N:
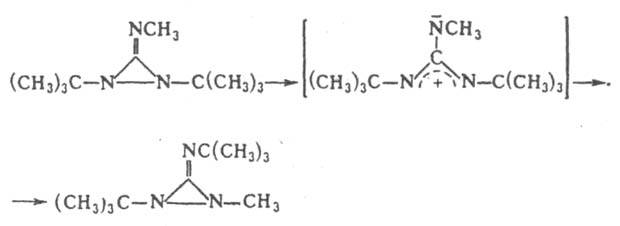
При взаимод. диазиридинонов с NaBH4 образуются формилгидразины. Диазиридинонимины при нагр. претерпевают изомеризацию, напр.:
Д. и его производные обычно синтезируют взаимод. альдегидов или кетонов с амином и аминирующим реагентом:
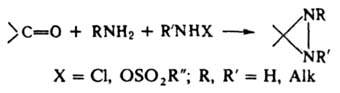
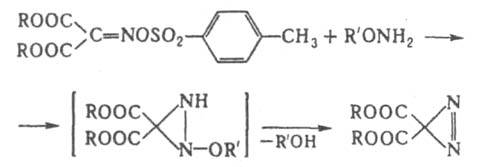
Производные с электроотрицат. заместителями в положении 3 получают по р-ции:
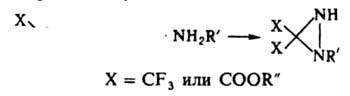
Осн. способ получения диазиридинонов и диазиридиномиминов - циклизация N-хлор-N,N-ди-тpет-алкилмочевин и замещенных N-хлоргуанидинов. 1,3,3-Триалкилдиазиридины проявляют психотропную активность. Замещенные Д., полученные на основе транс-дегидроандростерона, обладают гипотензивным, а N-фосфорилированные Д. цитостатич. действием. Лит.: Шмитц Э., Трехчленные циклы с двумя гетероатомами, пер. с нем., М., 1970, с. 105-70; Костяновский Р. Г., Шустов Г В., "Докл. АН СССР", 1977, т. 232, №5, с. 1081-84; Schmitz E., "Advances in Heterocyclic Chemistry", 1979, v. 24, p. 83-95. Г В. Шустов.
3Н-ДИАЗИРИН (циклодиазометан, диазациклопропен), мол. м. 42,04; бесцв. газ; т. кип. — 14°С; m5.10-30 Кл.м.
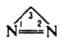
При фотолизе перегруппировывается в диазометан. При взаимод. с реактивом Гриньяра, литийорг. соед. или C2H5ZnI образует 1-алкилдиазиридины.
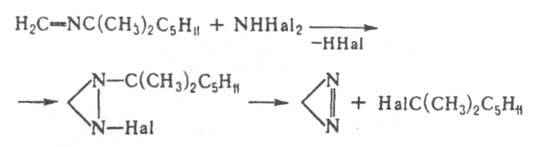
Получают Д. окислением диазиридина или действием дифтор- или дихлорамина на трет-октилазометин:
З а м е щ е н н ы е Д. Низшие 3-алкил-, 3,3-дифтор- и 3,3-бис-(трифторметил)-3Н-диазирины - газы, 3,3-диалкил-3Н-диазирины - жидкости, р-римые в орг. р-рителях. При УФ облучении или нагр. до ~ 160°С алкилзамещенные распадаются на N2 и карбены. Наиб. нестабильны 3-хлор-3-метокси-, 3-триметилсилил и 3-оксо-3Н-диазирины; последние при комнатной т-ре распадаются с образованием кетенов -продуктов перегруппировки Вольфа. При взаимод. 3-оксо-3Н-диазирина с гидразинами образуется 1-амино-1,2,3-триазолы, в р-циях 3,3-диалкил-3Н-диазиринов с карбонилами Cr, Mo, W, Fe - комплексы.
Осн. способ синтеза большинства замещенных Д. - окисление диазиридинов. Эфиры 3Н-диазирин-3,3-дикарбоновой к-ты обычно получают по р-ции:
3-Хлор(бром)-3Н-диазирины, являющиеся источниками карбенов в разл. р-циях, получают взаимод. амидинов RC(=NH)NH2 с гипогалогенитами Na в ДМСО. 3-Фтор-3Н-диазирин синтезируют дефторированием перфторированных диаминометана, триаминометана или гуанидина. 3-Карбокси-3Н-диазирины образуются при фотолизе диазосоединений, напр.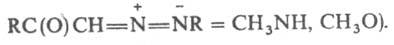 Среди производных 3Н-диазирин-3-алкилкарбоновых к-т известны в-ва, обладающие диуретич., гипогликемич., гипотензивным и психостимулирующим действием.
Д., его низшие 3-алкильные гомологи и 3,3-дифтор-3Н-диазирин взрывоопасны.
Лит.: Шмитц Э., Трехчленные циклы с двумя гетероатомами, пер. с нем., М., 1970, с. 171-245; Schmitz E., "Advances in Heterocyclic Chemistry", 1979, v. 24, p. 95-107; Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 698-701; Shustov G.V., Tavakalyan N. В., Kostyanovsky R.G., "Angew. Chem.", 1981, Bd 93, № 2. S. 206-207. Г. В. Шустов.
Среди производных 3Н-диазирин-3-алкилкарбоновых к-т известны в-ва, обладающие диуретич., гипогликемич., гипотензивным и психостимулирующим действием.
Д., его низшие 3-алкильные гомологи и 3,3-дифтор-3Н-диазирин взрывоопасны.
Лит.: Шмитц Э., Трехчленные циклы с двумя гетероатомами, пер. с нем., М., 1970, с. 171-245; Schmitz E., "Advances in Heterocyclic Chemistry", 1979, v. 24, p. 95-107; Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 698-701; Shustov G.V., Tavakalyan N. В., Kostyanovsky R.G., "Angew. Chem.", 1981, Bd 93, № 2. S. 206-207. Г. В. Шустов.


