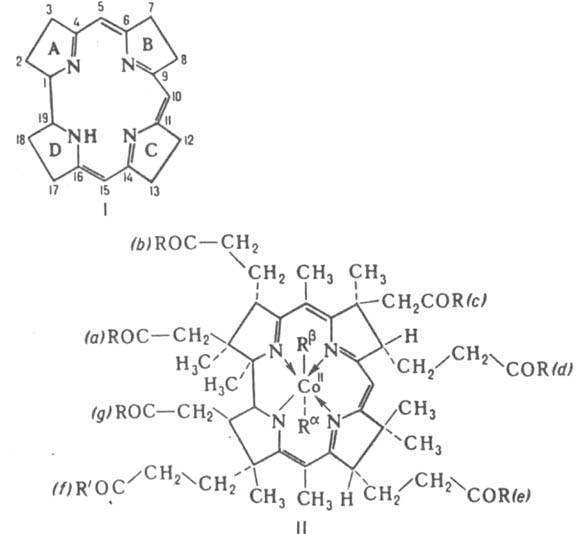
КОРРИНOИДЫ (коррины), прир. макрогетероциклич. соед., содержащие цикл коррина (ф-ла I). Структура коррина родственна порфину (см. Порфирины). Нумерация атомов в цикле и обозначения колец даются согласно номенклатуре ИЮПАК. Атомы С (5, 10 и 15), связывающие пиррольные циклы, наз. мезо-атомами. Молекулы найденных в природе К. обычно содержат разл. заместители и координационно связанный атом металла. При этом практически плоский цикл коррина является экваториальным лигандом, а др. связанные с атомом металла лиганды расположены перпендикулярно плоскости цикла (занимают транс-аксиальное положение). наиб. важны витамины В12, кобамидные ко-ферменты (см. Витамин В12) а также синтезируемые разл. микроорганизмами к-ты и их производные, содержащие в центре макроцикла атом Со (см. ф-лу II и табл.).
Карбоксильные группы в прир. К. обозначают буквами а-g, транс-аксиальные лиганды - символами. Ra и Rb, степень окисления атома металла в цикле - римскими цифрами (напр., Со1), цикл коррина-знаком [ ]. Для нек-рых К. существуют спец. обозначения, напр. Сbl, Сby.
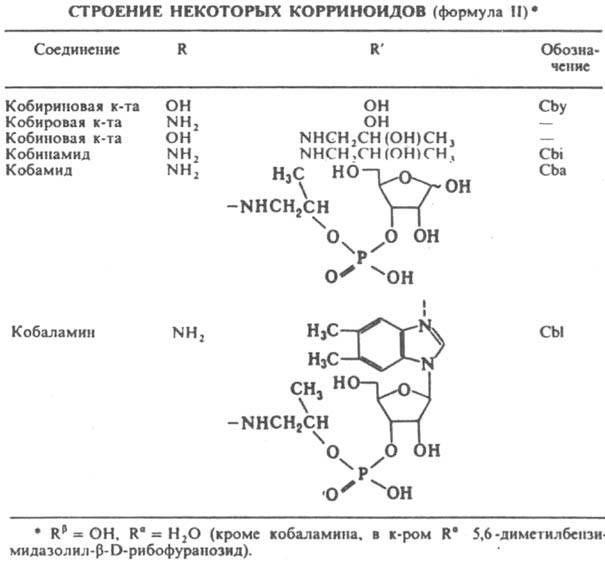
Для прир. металлсодержащих К. характерны три типа пространств. изомерии: I) координационная aDb-изомерия, напр. в аквацианокорриноидах:2) эпимеризация пропионамидных группировок
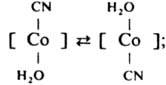
при атомах С-8 и С-13; 3) изменение конформации корринового кольца вследствие незначит. выведения атома металла из плоскости цикла коррина, сопровождающееся изменением упаковки атомов макроцикла. Большинство К. - высокоплавкие кристаллы (т. разл. 250-320 °С), окрашенные в фиолетовый или красный цвет; хорошо раств. в воде, этаноле, фенолах, хуже-в ДМФА, не раств. в СНСl3, ацетоне, диэтиловом эфире. Прир. К. без разложения раств. в конц. H2SO4. В УФ и видимой областях спектра lмакс 260-280, 340-370, 400, 520 и 550 нм. Макроциклич. система К. не обладает ароматичностью, несмотря на высокую степень делокализации 14p-электронов системы коррина и на большую прочность соответствующих металлокомплексов. Для К. с незамещенными мезо-положсниями С-5 и С-15 характерны р-ции электроф. замещения, напр. дейтерирование, галогенирование, циани-рование, нитрозирование по одному или неск. мезо-атомам. Для К., выделенных из прир. источников и содержащих Со, деметаллирование сопровождается расщеплением или значит. хим. модификацией макроцикла. Р-ции металлирования
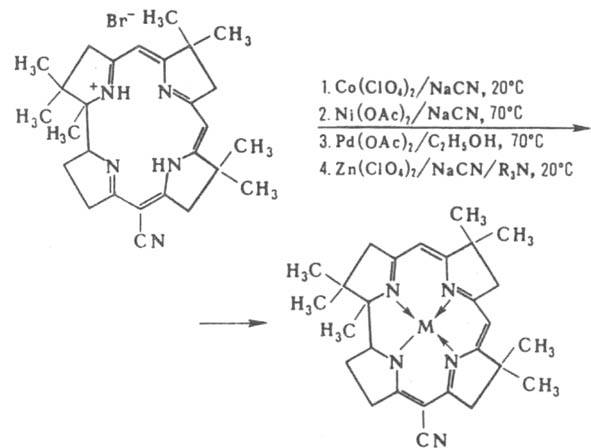
осуществляют обычно на синтетич. К. или на К., не содержащих Со, выделенных, напр., из микроорганизмов рода Chromatium. Так, действием солей разл. металлов на синтетич. 15-циано-1,2,2,7,7,12,12-гептаметилкорринийбромид м. б. получены соответствующие комплексы металлов, напр.:
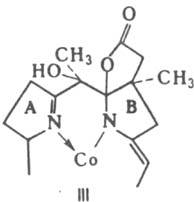
Металлoкомплексы с Zn и Cd менее устойчивы, чем К., содержащие в цикле металлы VIII группы. Окислит.-восстановит. превращения К., напр. под действием аскорбиновой к-ты, приводят к образованию гидроксилированных по атому С-5 производных, содержащих дополнит. лактонное кольцо (т. наз. желтые К., напр., ф-лы III). Характерные р-ции мн. К. связаны также с окислит.-восстановит. превращениями Со: [СоIII]D[СоII]D[Со1]. Восстановление протекает в условиях каталитич. гидрирования, а также под действием ацетата Сr(III), NaBH4, Zn в 10%-ном р-ре NH4Cl, гликолевой к-ты, тиолов и др. агентов. При этом форма, содержащая СоI, обладает очень высокой
нуклеофильностью и способна вступать в р-ции с разл. электрофилами, образуя устойчивые при обычных условиях органокорриноиды, содержащие s-связи Со—С. Особенность этих соед. состоит в способности расщепляться как по гомолитич. механизму с образованием Со и своб. радикалов, так и по гетеролитич. механизму с образованием карбанионов, карбкатионов и К., содержащих соотв. СоII и СоI. Среди органокорриноидов важнейшее биол. значение имеют коферменты 5'-дезоксиаденозил- и b-метил-кобаламины. Биохим. механизм активации, единый для всех В12 - зависимых коферментов, состоит в гомолитич. расщеплении связи Со—С. Синтез витамина В12 осуществлен Р. Вудвордом и А. Эшенмозером в 1972. Общий план двух разработанных
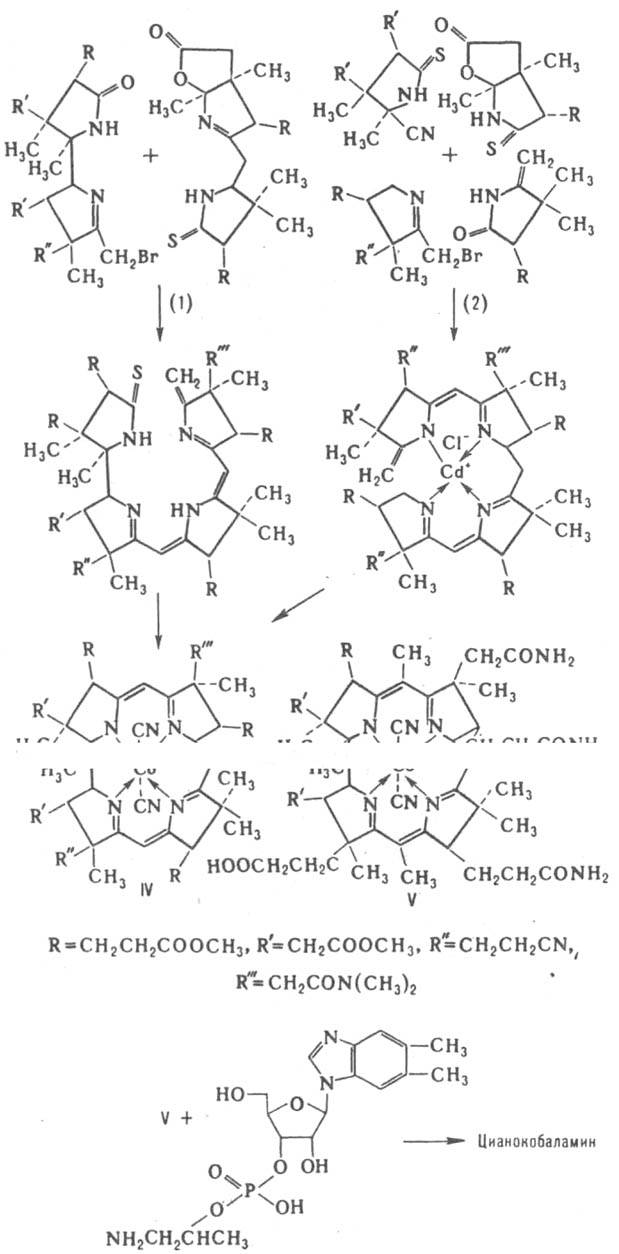
вариантов синтеза состоит в конденсации двух бис-пир-рольных частей (р-ция 1) или в конденсации четырех пиррольных колец (2) с образованием соед. IV, из к-рого с помощью разл. р-ций с заместителями (гидролиз амидных групп, аммонолиз эфирных групп и др.) и метилированием корринового кольца получают дицианокобировую к-ту (V). Взаимод. последней с 3'-(2-изопропиламино)фосфатом 5,6-диметилбензимидазолил-b-D-рибофуранозида приводит к цианокобаламину - лек. форме витамина В12. К., кроме разл. форм витамина В12, в т.ч. кобамидные коферменты, находят применение в качестве лек. препаратов анаболич. действия. Лит.: Хилл X. А. О., в кн.: Неорганическая биохимия, пер. с англ., т. 2, М.. 1978, с. 523-98; Юркевич А. М., Рудакова И. П., Структура, свойства и механизм действия кобаламиновых коферментов. Итоги науки и техники. Сер. Биоорганическая химия, т. 5, М., 1985; BI2, ed. by D. Dolphin, v. 1-2, N.-Y., 1981 А. М. Юркевич.

Для прир. металлсодержащих К. характерны три типа пространств. изомерии: I) координационная aDb-изомерия, напр. в аквацианокорриноидах:2) эпимеризация пропионамидных группировок
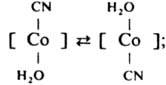
при атомах С-8 и С-13; 3) изменение конформации корринового кольца вследствие незначит. выведения атома металла из плоскости цикла коррина, сопровождающееся изменением упаковки атомов макроцикла. Большинство К. - высокоплавкие кристаллы (т. разл. 250-320 °С), окрашенные в фиолетовый или красный цвет; хорошо раств. в воде, этаноле, фенолах, хуже-в ДМФА, не раств. в СНСl3, ацетоне, диэтиловом эфире. Прир. К. без разложения раств. в конц. H2SO4. В УФ и видимой областях спектра lмакс 260-280, 340-370, 400, 520 и 550 нм. Макроциклич. система К. не обладает ароматичностью, несмотря на высокую степень делокализации 14p-электронов системы коррина и на большую прочность соответствующих металлокомплексов. Для К. с незамещенными мезо-положсниями С-5 и С-15 характерны р-ции электроф. замещения, напр. дейтерирование, галогенирование, циани-рование, нитрозирование по одному или неск. мезо-атомам. Для К., выделенных из прир. источников и содержащих Со, деметаллирование сопровождается расщеплением или значит. хим. модификацией макроцикла. Р-ции металлирования

осуществляют обычно на синтетич. К. или на К., не содержащих Со, выделенных, напр., из микроорганизмов рода Chromatium. Так, действием солей разл. металлов на синтетич. 15-циано-1,2,2,7,7,12,12-гептаметилкорринийбромид м. б. получены соответствующие комплексы металлов, напр.:

Металлoкомплексы с Zn и Cd менее устойчивы, чем К., содержащие в цикле металлы VIII группы. Окислит.-восстановит. превращения К., напр. под действием аскорбиновой к-ты, приводят к образованию гидроксилированных по атому С-5 производных, содержащих дополнит. лактонное кольцо (т. наз. желтые К., напр., ф-лы III). Характерные р-ции мн. К. связаны также с окислит.-восстановит. превращениями Со: [СоIII]D[СоII]D[Со1]. Восстановление протекает в условиях каталитич. гидрирования, а также под действием ацетата Сr(III), NaBH4, Zn в 10%-ном р-ре NH4Cl, гликолевой к-ты, тиолов и др. агентов. При этом форма, содержащая СоI, обладает очень высокой

нуклеофильностью и способна вступать в р-ции с разл. электрофилами, образуя устойчивые при обычных условиях органокорриноиды, содержащие s-связи Со—С. Особенность этих соед. состоит в способности расщепляться как по гомолитич. механизму с образованием Со и своб. радикалов, так и по гетеролитич. механизму с образованием карбанионов, карбкатионов и К., содержащих соотв. СоII и СоI. Среди органокорриноидов важнейшее биол. значение имеют коферменты 5'-дезоксиаденозил- и b-метил-кобаламины. Биохим. механизм активации, единый для всех В12 - зависимых коферментов, состоит в гомолитич. расщеплении связи Со—С. Синтез витамина В12 осуществлен Р. Вудвордом и А. Эшенмозером в 1972. Общий план двух разработанных

вариантов синтеза состоит в конденсации двух бис-пир-рольных частей (р-ция 1) или в конденсации четырех пиррольных колец (2) с образованием соед. IV, из к-рого с помощью разл. р-ций с заместителями (гидролиз амидных групп, аммонолиз эфирных групп и др.) и метилированием корринового кольца получают дицианокобировую к-ту (V). Взаимод. последней с 3'-(2-изопропиламино)фосфатом 5,6-диметилбензимидазолил-b-D-рибофуранозида приводит к цианокобаламину - лек. форме витамина В12. К., кроме разл. форм витамина В12, в т.ч. кобамидные коферменты, находят применение в качестве лек. препаратов анаболич. действия. Лит.: Хилл X. А. О., в кн.: Неорганическая биохимия, пер. с англ., т. 2, М.. 1978, с. 523-98; Юркевич А. М., Рудакова И. П., Структура, свойства и механизм действия кобаламиновых коферментов. Итоги науки и техники. Сер. Биоорганическая химия, т. 5, М., 1985; BI2, ed. by D. Dolphin, v. 1-2, N.-Y., 1981 А. М. Юркевич.


