СВОЙСТВА ФТОРИДОВ КСЕНОНА
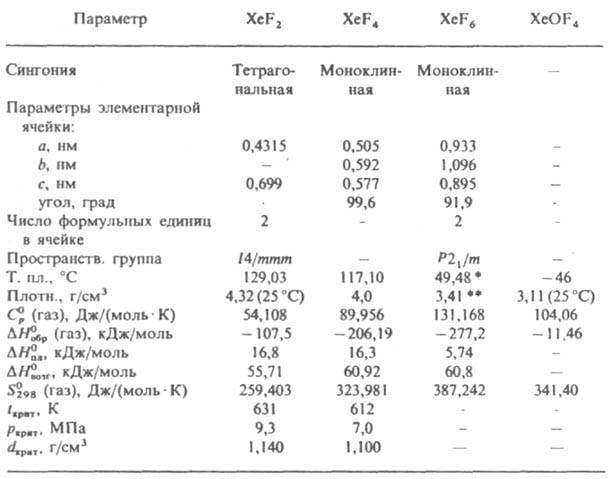
* Т. кип. 75,65 °С. ** Плотн. жидкого 3,23 г/см3 (50,4 °С).
Молекула дифторида XeF2 линейная, длина связи Хе—F 0,2 нм. Ур-ние температурной зависимости давления пара над твердым в-вом lgp(Па)=-3057,67/T — -1,2352lgT+16,0946 (273-390 К). Раств. в CH3CN (0,169 г/см3 при 0 °С), SO2, BrF3, BrF5, HF (1,1 г/см3 при 0°С), IF5, 3HF.NOF (2,75 г/см3 при 17 °С). пиридине, ДМСО, воде (0,025 г/см3 при 0°С и 0,042 г/см3 при 25 °С). Водой гидролизуется. Водные р-ры XeF2 окисляют ВrО3 до ВrO4-, Сr(III) до Cr(VI), Сl- до Сl2, Np(V) до Np(VII) и др. При умеренных т-рах взаимод. с мн. простыми в-вами, их оксидами, фторидами и др. солями с образованием высших фторидов. При взаимод. с НСlO4, CF3COOH и нек-рыми др. к-тами дает соли Хе2+ , с первичными алифатич. спиртами (С1-4) - альдегиды, с бензолами - фторбензолы; вызывает полимеризацию пиридина. Дифторид - основание Льюиса; из него получены соед. ионного типа, напр. ХеF+SbF-6, (XeF+ )2SnF62-, и молекулярные, напр. XeF2.XeF4, XeF2.IF5, XeF2.UF6 и др. Р-цией XeF2 с HN(SO2)2 синтезированы FXeN(SO2F)2 и Xe[N(SO2F)2]2. Применяют XeF2 как фторирующий агент в неорг. и орг. синтезах, при вскрытии минер. сырья, для получения соед. Хе(II). Хранят XeF2 в герметичных контейнерах из фторопластов и разл. металлов. Гексафторид XeF6 в газообразном виде представляет собой равновесную смесь трех электронных изомеров разл. геом. конфигурации; длина связи Хе—F 0,175-0,188 нм. Кристаллич. гексафторид существует в четырех модификациях: при 18,65-49,48 °С устойчива моноклинная форма, от -19,35 до 18,05 °С - ромбич. (а = 1,701 нм, b=1,204 нм, с=0,857 нм, z=16, пространств. группа Рпта), ниже - 19,35 °С - моноклинная (а = 1,680 нм, b = 2,393 нм, с = = 1,695 нм, р = 90,7°, z = 64, пространств. группа Р21/b), от — 180,0 до 49,48 °С существует также кубич. модификация (а = 2,506 нм, z = 144, пространств. группа Рт3с). Ур-ния температурной зависимости давления пара: над твердым в-вом lgp(Па)=-3313,5/T+14,7172 (254-292 К), lgp(Па)=-3093,9/T+13,9646 (292-322 К); над жидким lgp(Па)=-6170/T-23,6781gT+82,890 (323-349 К). Р-римость (в г/см3): в безводном HF-1,47 (20°C), BrF5-2,70 (22°С). Гексафторид проявляет амфотерные св-ва; как к-та образует соед. состава M2[XeF8] (М=Cs, Rb, К, Na, NF4, NO) и M[XeF7] (M=Cs, Rb, NF4, NO2), как основание-соли, напр. XeF5+AuF6-, Xe2F11+SbF6-, (ХеР5+)2NiF62-. Взаимод. с мн. простыми в-вами и хим. соед. с образованием высших фторидов. Контролируемым гидролизом XeF6 получают оксофториды Хе и ХеО3, при гидролизе в щелочной среде - ксенаты и перксенаты (см. Ксенон). Взаимод. XeF6 с орг. в-вами, как правило, сопровождается взрывом. Применяют XeF6 в неорг. синтезе, для получения соед. Хе. В сухой атмосфере XeF6 взрывобезопасен, во влажном воздухе гидролизуется с образованием ХеО3 (взрывчат). Жидкий XeF6 обладает высокой коррозионной активностью. Хранят его в герметичных емкостях из никеля или монель-металла. В результате гидролиза XeF6 и XeF4 образуются оксофториды-ХеОР4, XeO2F2, XeOF2, XeO3F2, XeO2F4. Эти соед., кроме XeOF4, малоустойчивы. Оксотетрафторид XeOF4 - бесцв. жидкость; раств. в безводном HF; гидролизуется с образованием XeO2F2 и ХeО3; проявляет амфотерные св-ва, образуя, напр., Cs+XeOF-5, XeOF3AsF-6, XeOF4.XeOF3+SbF-6 , 2XeOF4.VF5 и др. К.ф. раздражают и обжигают кожу и слизистые оболочки; ПДК 0,05 мг/м3. Лит. см. при ст. Благородные газы. В. А. Легасов. В. Б. Соколов.


