НАТРИЯ СУЛЬФАТ Na2SO4,
бесцв. кристаллы; известен в четырех полиморфных модификациях (см. табл.); показатели
преломления: меньший Np = 1,469, средний Nm
= 1,476, больший Ng = 1,481; кристаллизуется из водных
р-ров выше 32,384 °С. В интервале от -1,2 до 32,4 °С кристаллизуется
декагидрат, от -3,5 до 24,25 °С- также метастабильный гептагидрат. Р-римость
безводного Н.с. в воде 21,9% по массе (25 °С). Т. кип. насыщ. водного р-ра
(29,7% по массе Н.с.) 102,88°С. Плохо раств. в водно-спиртовых средах; р-римость
при 20 °С в этаноле 0,439% по массе, метаноле-2,40%. С K2SO4,
Li2SO4 и рядом др. образует непрерывный ряд твердых р-ров,
с сульфатами Sc и Y-двойные соли, с SrSO4 - эвтектику.
Н.с. встречается в природе
в виде минералов тенардита Na2SO4, мирабилита (глауберова
соль) Na2SO4.10H2O, входит в состав
астрахонита Na2Mg(SO4)2.4H2O,
вантгоф-фита Na6Mg(SO4)4, глауберита Na2Ca(SO4)2
и др. Наиб. крупные запасы Н.с. в СССР, США, Чили, Испании и др.
Мирабилит выделяют из прир.
залежей, из рапы соляных озер и обезвоживают при 100°С. На хим. предприятиях
Н.с. получают как побочный продукт при произ-ве соляной к-ты, соед. Сr, утилизации
сульфатных щелоков в произ-ве искусств. волокна, на металлургич. заводах и т.д.
Н.с.-компонент шихты в произ-ве стекла; используется при сульфатной варке целлюлозы,
при крашении хл.-бум. тканей; сырье для получения силикатов Na, Na2S,
H2SO4, (NH4)2SO4, соды
и др.; компонент осадит. ванны в произ-ве вискозного волокна; глауберова соль-слабит.
ср-во. ПДК в воздухе рабочей зоны 10,0 мг/м3.
Г и д р о с у л ь ф а т
NaHSO4-бесцв. кристаллы (см. табл.); претерпевает два полиморфных
превращ. при 140 и 170°С; показатели преломления: Np = 1,43,
Nm = 1,46, Ng = 1,47; р-римость в воде 22,2%
по массе (25 °С), 33,3% (100 °С), в этаноле-1,4% (25 °С). Образует
моногидрат NaHSO4 x х Н2О-бесцв. гигроскопичные кристаллы;
при нагр. сначала переходит в безводную соль, а затем в Na2S2O7.
Гидрат получают растворением мирабилита в 20%-ной H2SO4
с послед. упариванием на водяной бане и охлаждением, безводную соль - кристаллизацией
из расплава смеси Н.с. с конц. H2SO4. Гидросульфат Na-флюс
в цветной металлургии, реагент для перевода труднорастворимых оксидов в р-римые
сульфаты.
СВОЙСТВА СУЛЬФАТА И
ГИДРОСУЛЬФАТА НАТРИЯ
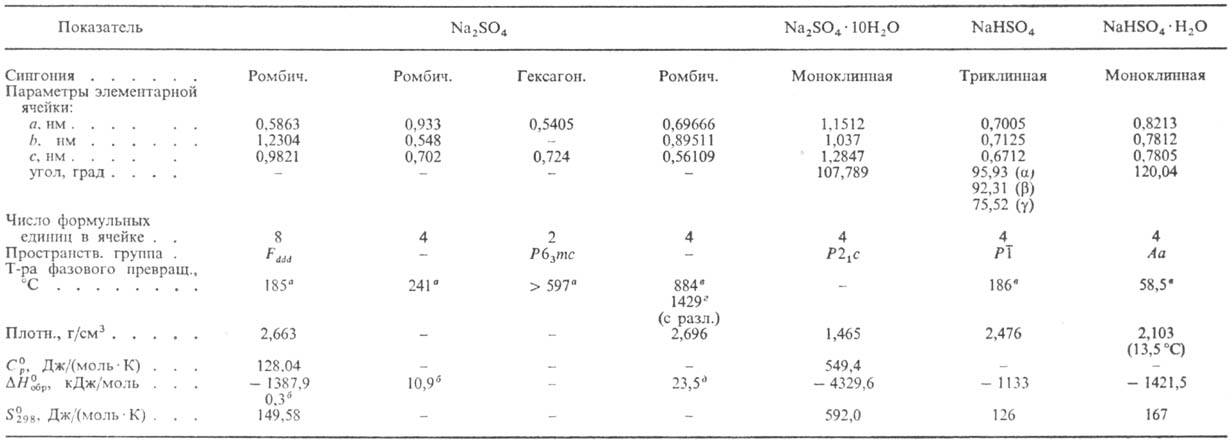
a Т-ра
полиморфного перехода. б DH полиморфного перехода.
в Т-ра плавления. г Т-ра кипения. д
DH0пл .
Лит.: Шихеева Л.
В., Зырянов В. В., Сульфат натрия. Свойства и производство, Л., 1978. Н.С.
Рукк.


