НИТРОЗИРОВАНИЕ, введение
нитрозогруппы —NO в молекулы орг. соединений. Н. может проходить по электроф.
и радикальному механизмам; активные частицы в этих р-циях-соотв. катион нитрозония
NO+ и радикал NO.. H. может осуществляться по атомам С,
N, О замещением атома водорода (прямое Н.) или др. функц. групп либо в результате
присоединения группы NO по кратной связи.
Осн. электроф. нитрозирующие
агенты - азотистая к-та HNO2, нитрозилсерная к-та ONOSO3H,
нитрозилгалогениды (напр., NOCl), оксиды азота N2O4, N2O3,
NO, алкил- или ацилнитриты, 3-нитро-N-нитрозокарбазол, соли нитрозония (гл.
обр. NOBF4). Нек-рые переносчики катиона нитрозония переходят друг
в друга, напр.:
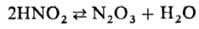
Чаще всего электрофильное
Н. протекает как прямое Н. sp3-гибридизованного атома С, имеющего
подвижный атом Н [напр., во фрагментах СН2СО, CH(NO2),
CH(CO)2, циклопентадиене и т.п.], атома N в первичных и вторичных
аминах, амидах, гидразинах, гетероциклич. соед., атома О в спиртах, к-тах, фенолах.
Третичные ароматич. амины
нитрозируются в пара- и реже в орто-положения, вторичные-в пара-положение,
при этом сначала происходит N-нитрозирование, затем перегруппировка под действием
к-т (Фишера-Хеппа перегруппировка):
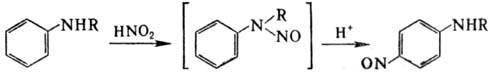
По аналогичной схеме может
происходить Н. первичных ароматич. аминов (HNO2, кислый катализ)
и фенолов (иногда при основном катализе). Известны др. примеры миграции группы
NO от атома N к атому С:
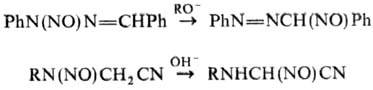
Н. путем замещения к.-л.
функц. группы при атоме С наблюдается редко; наиб. распространено замещение
карбоксильной группы в ароматич. соед.:
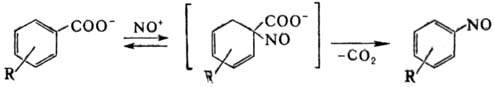
Подобное замещение в алифатич.
ряду, видимо, проходит с промежуточным О-нитрозированием:
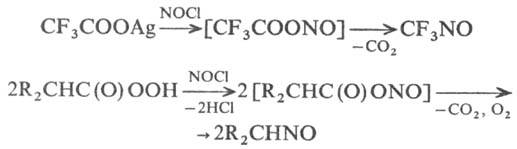
Электроф. присоединение
нитрозилгалогенидов, N2O4, нитрозилсерной к-ты и HNO2
по связи С=С -распространенный метод синтеза замещенных С-нитрозопроизводных,
напр.:
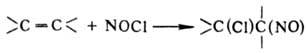
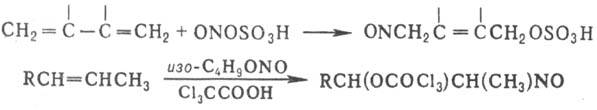
При Н. соед. с кратной
связью может происходить присоединение нитрозирующего агента в положение 1,4;
иногда вместе с NO+ присоединяется "внешний" нуклеофил,
напр.:
Оксимы присоединяют NOCl
по связи C=N:
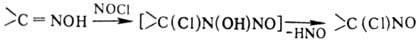
Для Н. по радикальному
механизму обычно применяют оксиды азота (NO, N2O3, N2O4),
NOCl, алкилнитриты, реже-др. реагенты, напр. N-нитрозамины. Р-цию проводят при
облучении или повыш. т-ре, либо инициируют радикальными агентами; субстратами
служат соед. со связями С—Н, С—Hal, возможно также присоединение оксидов азота
и NOCl по связям С=С. К радикальным р-циям относится пиролиз алкил- или ацилнитритов,
протекающий как внутримолекулярное Н. (Бартона реакция).
Известно фотохимическое
Н. олефинов N-нитрозаминами:
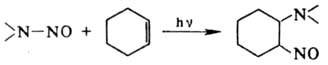
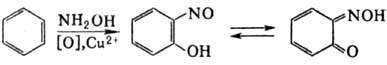
Окислительное Н. ароматических
соед. под действием гидроксиламина в присут. окислителей и солей тяжелых металлов
приводит к о-нитрозофенолам (р-ц и я Б а у-д и ш а):
Н. широко используют в
препаративных синтезах, напр. для трансформации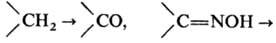
 и др.; N-нитрозирование—первая стадия диазотирования,
а также превращ. монозамещенных гидразинов в амины или азиды. Н. используют
в синтезах красителей, лек. ср-в, мономеров для каучуков.
и др.; N-нитрозирование—первая стадия диазотирования,
а также превращ. монозамещенных гидразинов в амины или азиды. Н. используют
в синтезах красителей, лек. ср-в, мономеров для каучуков.
Лит.: Ингольд К.,
Теоретические основы органической химии, пер. с англ., 2 изд., М., 1973, с.
270-73, 313-15, 513-27. См. также лит. при ст. Нитроза-соединения. С. Л.
Иоффе.


