НИТРОТОЛУОЛЫ, соед.
общей ф-лы СН3С6Н5-n(NO2)n.
Наиб. изучены мононитротолуолы ф-лы I, мол.м. 137,14. 2-и 3-Н. (при 20 °С)-светло-желтые
жидкости, 4-Н.-бесцв. или
светло-желтые кристаллы (табл. 1); 2-Н. существует в метастабильной
(a) и стабильной (b) модификациях. Все изомеры
хорошо раств. в этаноле, диэтиловом эфире, бензоле, ацетоне; р-римость в воде
(при 30 °С): 2-Н.
0,0652%, 3-Н. 0,0498%, 4-Н. 0,0442%. Окисление соед. ф-лы I под действием КМnО4,
К2Сr2О7 или
МnО2 в кислой среде, а также K3[Fe(CN)6] в
щелочной среде приводит
к соответствующим нитробензойным к-там, электрохим.
окисление (в СН3СООН или Н2SО4)-к нитробензальдегидам.
При кипячении с р-ром КОН 2-Н. диспропорционирует
до 2-аминобензойной (антраниловой) к-ты. Восстановление
металлами в кислой среде (для 3-Н. также в нейтральной и
щелочной средах) приводит к толуидинам; действие Fe или Zn в
щелочной среде-к азо-, азокси- и гидразосоединениям. Хлорирование под действием
Сl2 протекает в ядро и в боковую цепь; так, из 4-Н. в условиях радикального
процесса образуются 4-нитробензилхлорид, а в присут. FeCl3 или SbСl3-4-нитро-2-хлортолуол.
При хлорировании 2-Н., кроме того, наблюдается замещение группы NO2
на атом хлора с образованием смеси 2-хлортолуола и 2-хлорбензилхло-рида. При
сульфировании 4-Н. превращ. в 2-метил-5-нитро-бензолсульфокислоту, при нагр.
с КОН в спирте-в 4,4'-ди-нитростильбен.
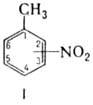
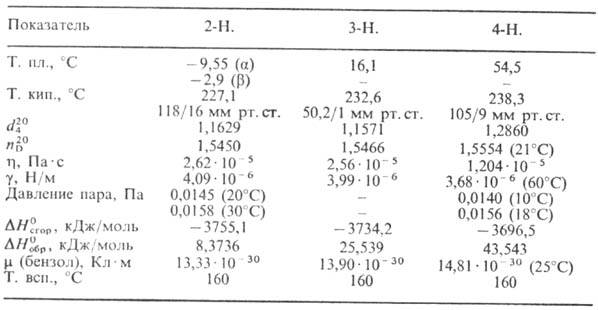
Табл. 1.-СВОЙСТВА МОНОНИТРОТОЛУОЛОВ
При нитровании смесью HNO3 и H2SO4 мононитротолуолы последовательно превращ. в динитротолуолы (мол. м. 182,14; табл. 2) и тринитротолуол. Из 2-Н. образу
ется смесь 2,4- и 2,6-динитроизомеров,
из 3-Н.-2,4-динитро-толуол, из 3-Н.-3,4-динитротолуол с небольшими примесями
2,3-, 2,5- и 3,5-изомеров.
Табл. 2.-НЕКОТОРЫЕ
СВОЙСТВА ДИНИТРОТОЛУОЛОВ

2,6-Динитротолуол существует
в стабильной (a) и двух нестабильных (b) модификациях. Все динитротолуолы хорошо
раств. в ацетоне, бензоле, умеренно-в этаноле и диэтиловом эфире, плохо-в воде.
Хим. св-ва динитропроизводных
обусловлены влиянием двух нитрогрупп на метильную группу, вследствие чего последняя
способна замещать атомы Н на др. группы, напр. при взаимод. с бензальдегидом:
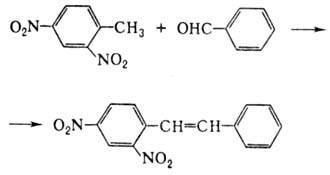
Под действием щелочи динитротолуолы
(особенно в присут. окисляющих агентов, напр. NaClO или О2 воздуха)
образуют производные стильбена.
Ди- и тринитротолуолы с
ароматич. углеводородами и аминами образуют мол. комплексы с переносом заряда
обычно состава 1:1. Устойчивость таких комплексов возрастает с увеличением числа
групп NO2 в молекуле.
Др. тип комплексов - анионные
s-комплексы (т.наз. комплексы Майзенхаймера) - образуется при взаимод. ди- и
три-нитротолуолов с нуклеофилами ОН-, ОСН-3,
N-3, CN- или алифатич. аминами.
В пром-сти Н. получают
гл. обр. жидкофазным нитрованием толуола нитрующей смесью (55-66% H2SO4,
28-32% HNO3 и 12-20% Н2О) по непрерывной технологии. Для
увеличения выхода 4-Н. и во избежание побочной р-ции окисления продуктов процесс
проводят при 25 °С в присут. Н3РО4, безводного CaSO4
или бензол-1,3-дисульфокислоты. Р-ция протекает на пов-сти раздела фаз и поэтому
требует энергичного перемешивания реагентов; после добавления нитрующей смеси
т-ру повышают до 35-40 °С. Газофазное нитрование толуола под действием HNO3
проводят при 100-140 °С в присут. катализатора (5%-ный р-р H2SO4,
нанесенный на SiO2 или Аl2О3).
Техн. продукт жидкофазного
нитрования содержит обычно 55-60% 2-Н., 3-4% 3-Н. и 35-40% 4-Н., к-рые выделяют
после отгонки с паром избытка толуола и высушивании остатка, вымораживая 4-Н.
и разделяя 2- и 3-Н. перегонкой в вакууме. В продуктах газофазного нитрования
соотношение 4- и 2-изомеров
составляет 1,84; конверсия толуола 61%.
Техн. динитротолуол, получающийся
нитрованием техн. мононитротолуола нитрующей смесью при 70-80°С, состоит
гл. обр. из 2,4- и 2,6-изомеров (соотв. 75 и 20%): кристаллы желтого цвета,
т.пл. 50-54 °С, плотн. 1,32 г/см3 (71 °С); используется без
разделения изомеров для получения тринитротолуола.
2-Н. м.б. получен также
из 2,4-динитробензола при его обработке (NH4)2S с послед.
диазотированием и кипячением с этанолом, З-Н.-ацетилированием n-толуидина
с послед. нитрованием, диазотированием и кипячением с этанолом.
Методы анализа Н. основаны
на колориметрич. определении окрашенных р-ров смеси Н. в H2SO4.
По поглощению в областях 436 и 305 нм определяют соотв. 2-Н. и 4-Н. Др. метод
анализа Н.-восстановление их до соответствующих толуидинов и определение последних
фотометрически.
Н. токсичны, всасываются
через кожу, окисляют гемоглобин крови в метгемоглобин, вызывают анемию, отрицательно
влияют на центр. нервную систему, ф-цию почек и печени. Для всех мононитротолуолов
ПДК 3 мг/м3, ЛД50 1,46-1,68 г/кг (мыши, перорально); для
динитротолуолов ПДК 1 мг/м3, ЛД50 0,5-0,8 г/кг (мыши,
перорально).
Н. применяют в синтезе
толуидинов, хлорнитротолуолов, нитротолуолсульфокислот, нитротолуолсульфохлоридов,
основных красителей (2- и 4-Н.), 4-нитробензойной к-ты (4-Н.), в произ-ве гербицидов
и каучуков. 2-Н.-реагент для обнаружения и фотометрич. определения разл. окислителей
[Сl2, N03-, NO-2, Au(III),
Cr(VI), Cu(II), Cu(III)], а также HCN в воздухе.
Лит. см. при ст. Нитросоединения. В. И. Ерашко.


