ПЕРИМИДИН (1H-бензо[d,е]хиназолин), ф-ла I; мол. м. 168,2; желто-зеленые кристаллы; т. пл. 2220C; раств. в эта-ноле и др. полярных орг. р-рителях, не раств. в воде; основание, рКa 6,0; с сильными к-тами образует соли; m 9,6· 10-30Кл·м.
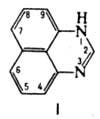 - . · . ·
- . · . ·
Молекулы П. ассоциированы
вследствие образования водородных связей. Для П. характерна прототропная таутомерия:
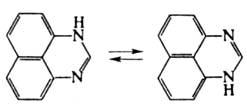 · · ·'
· · ·'
П.- 14p-электронная система,
электронная плотность к-рой смещена в сторону нафталинового фрагмента. Это приводит
к возникновению отрицат. заряда в положениях 4, 6, 7, 9 и положительного-в положении
2.
П. легко вступает в разл.
р-ции электроф. замещения (нитрование, галогенирование и др.). Электрофил атакует
положения 4, 6, 7 и 9 нафталинового кольца, причем часто замещаются все четыре
атома H.
Под действием алкоголятов
щелочных металлов и др. сильных оснований П. превращ. в анион (II), к-рый легко
окисляется; поэтому все р-ции П. в щелочной среде проводят в инертной атмосфере.
Алкилирование аниона П. приводит к образованию N-замещенных производных (III),
к-рые при нагр. с алкилиодидами образуют четвертичные соли (IV), напр.:
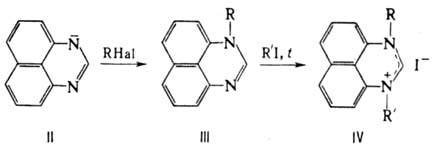
Св-ва нек-рых N-производных
П.: N-метил, т пл. 120 1210C; N-ацетил, т.пл. 176 1780C;
N-бензил. т пл 1340C; N-фенил, т.пл. 1100C.
N-Алкилзамещенные П. легко
реагируют с нуклеофилами по положению 2. Так, при действии NaNH2
в диметиланили-не при 1300C образуются N-алкил-2-аминоперимидины.
При сплавлении N-алкилзамещенных с порошкообразным KOH при 190 oC
с высоким выходом получаются N-алкил-перимидоны. Мсталлоорг. соед. присоединяются
обычно по связи C=N соед. III или IV с образованием соотв. 1,2-ди-алкил- и 1,2,3-триалкилдигидроперимидинов.
Высокой активностью в р-циях с нуклеофилами обладают 2-хлорпери-мидины, атомы
галогена в к-рых легко обмениваются на амино-, алкокси-, азидо- и гидразиногруппы.
Четвертичные соли при действии водной щелочи диспропорционируют с образованием
смеси 1,3-диалкилперимидонов и 1,3-ди-алкил-2,3-дигидроперимидинов:
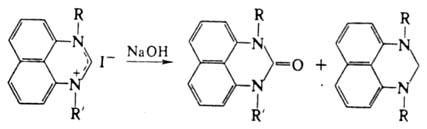
П. и его производные сильные
доноры электронов; с хлоранилом, 1,3,5-тринитробензолом и др. акцепторами электронов
образуют глубоко окрашенные комплексы с переносом заряда. П. в мягких условиях
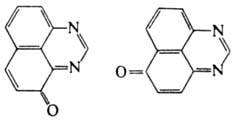
окисляется под действием соли Фреми (KOSO2)2NO•
с образованием смеси 4Н-перимидин-4-она и 6Н-перимидин-6-она:
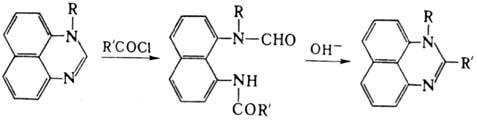
Под действием хлорангидридов
ароматич. к-т в присут. (C2H5)3N N-алкилзамещенные
П. превращ. в производные 1,8-диаминонафталина, к-рые при нагр. со щелочью циклизуются
в 1,2-дизамещенные П.:
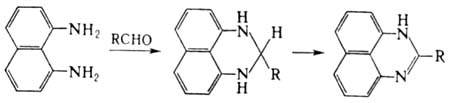
П. получают кипячением
1,8-диаминонафталина с HCOOH. 2-Алкилзамещенные П. синтезируют действием на
1,8-диаминонафталин хлорангидридов, ангидридов, сложных эфиров, иминоэфиров.
В ряде случаев используют р-цию 1,8-диаминонафталина с альдегидами; при этом
сначала получают 2-алкил-2,3-дигидроперимидины, к-рые затем де-гидрируют в присут.
Pd/C, серы или пиросульфата Na:
Производные П. -азокрасители,
люминофоры, пестициды, лек. препараты. 2-Аминоперимидин вследствие низкой р-римости
его сульфата используют для количеств. определения H2SO4
в атмосфере.
Лит. Пожарский А.
Ф . Дальниковская В В., "Успехи химии", 1981. т 50, в. 9. с. 1559.
А.Ф. Пожарский.


