ПОЛИЭЛЕКТРОЛИТЫ, полимеры,
в макромолекулах к-рых содержатся ионогенные группы. В р-ре макромолекула П.-полиион,
окруженный эквивалентным кол-вом про-тивоионов (малых ионов с зарядами противоположного
знака). Размеры полииона на неск. порядков больше, чем противоионов.
Различают поликислоты, полиоснования и полиамфо-литы. Сильные П. в водных р-рах полностью ионизованы независимо от значения рН. Сильные поликислоты содержат сульфо-, сульфатные или фосфатные группы, напр. поливинилсульфокислота [—CH2CH(SO3H)—]n, сильные полиоснования-четвертичные аммониевые группы, напр. ионены:
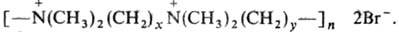
Заряд слабых поликислот
и полиоснований определяется величинами констант диссоциации К ионогенных
групп и существенно зависит от рН р-ра. Типичные слабые поликислоты содержат
карбоксильную группу, напр. полиакриловая кислота [—СН2СН(СООН)—]и,
слабые полиоснования - первичные, вторичные, третичные аминогруппы, способные
протонироваться в водных средах, напр, цоливи-ниламин [—CH2CH(NH2)—]n,
поливинилпиридины. Поли-амфолиты содержат как кислотные, так и основные
группы. Суммарный заряд полиамфолитов при изменении рН р-ра может менять знак;
значение рН, при к-ром он равен нулю, наз. изоэлектрич. точкой рI. Полиамфолитами
являются белки и нуклеиновые к-ты.
П. могут быть как линейными,
так и пространственно сшитыми (о последних см. Ионообменные смолы).
Конформации в растворах.
Из-за наличия кулоновских взаимодействий (отталкивания одноименно заряженных
групп в макромолекуле и притяжения противоионов к полииону) поведение водных
р-ров линейных П. существенно отличается от поведения как неионогенных (незаряженных)
полимеров (см. Растворы полимеров), так и низкомол. электролитов (см.
также Растворы электролитов). Благодаря электростатич. отталкиванию между
одноименно заряженными ионогенными группами макромолекула П. стремится развернуться
и приобрести более асимметричную форму по сравнению с формой статистич. клубка,
характерной для незаряженных цепей. Поэтому в р-рах полиионы имеют значительно
большие размеры и асимметрию, чем макромолекулы той же хим. природы, но лишенные
заряда. Эта особенность П. обнаруживается при вискозиметрич., седиментац. и
диффузионных исследованиях, при изучении явлений переноса в р-рах П. в электрич.
полях, напр. электрофореза и электропроводности.
Размеры полииона в водных
р-рах сильно зависят от линейной плотности заряда (величины заряда П., приходящейся
на единицу его контурной длины). Так, при диссоциации всех карбоксильных групп
высокомол. полиакриловой к-ты объем, занимаемый таким полиионом в разб. бессолевом
водном р-ре, увеличивается более чем на два порядка по сравнению с объемом макромолекулы
полиакриловой к-ты, в к-рой все карбоксильные группы находятся в
протонир. форме —СООН. Разворачивание цепи П. проявляется в прогрессирующем
возрастании приведенной вязкости (hпр = hуд/с,
где hуд-уд. вязкость) бессолевого водного р-ра П. при уменьшении
его концентрации с (полиэлектролитный эффект), в то время как для р-ров
неионогенных макромолекул характерно линейное уменьшение hпр
при разбавлении. Объясняется этот эффект тем, что при разбавлении р-ров П. увеличивается
объем. в к-ром распределяются противоионы, экранирующие кулоновское отталкивание
между фиксир. зарядами полииона, вследствие чего возрастает их отталкивание
и происходит прогрессирующее разворачивание полииона.
Конформация П. определяется
также наличием в р-ре низкомол. электролитов, напр. простых (1,1-валентных)
солей. Введение их в р-р приводит к экранированию зарядов полииона и уменьшению
электростатич. отталкивания между ними, а следовательно, и степени разворачивания
полииона, зависящей от концентрации низкомол. электролита. При значит. концентрациях
солей (порядка 1 М) вклад кулоновских взаимодействий в разворачивание цепей
исчезает и их размеры совпадают с размерами неионогенных цепей той же хим. природы.
Дальнейшее введение низкомол. электролитов в р-ры П. может привести к выделению
П. в отдельную, чаще всего жидкую фазу (высаливание).
Изменение конформации макромолекул
П. необходимо учитывать при изучении зависимости св-в р-ров П. от их концентраций.
В этих случаях обычно используют режимы разбавлений, при к-рых ионная сила р-ра
остается неизменной,-т. наз. изоионное разбавление. Наилучшие результаты дает
метод диализа р-ров П. разл. концентраций против общего водного р-ра простой
соли. Часто измерения проводят при высоких концентрациях простых солей, достаточных
для эффективного экранирования кулоновских взаимодействий.
Полиамфолиты в изоэлектрич.
точке имеют компактную конформацию, стабилизированную кулоновским притяжением
между противоположно заряженными группами. Поэтому экранирование электростатич.
взаимод. при введении в р-р низкомол. солей сопровождается разворачиванием макромолекул.
Электрохимические свойства
растворов. Последние резко отличаются от св-в р-ров низкомол. электролитов.
Полимерные к-ты и основания заметно слабее своих низкомол. аналогов, и в противоположность
последним их значения К не являются характеристич. величинами, но зависят
от степени диссоциации П. (a). Способность поликислоты отщеплять протон,
а полиоснования присоединять его ослабляется при увеличении a (т.е. величины
заряда полииона) из-за прогрессирующего возрастания кулоновского взаимод. между
полиионом и противоионами (напр., в случае поли-кислоты диссоциирующий протон
с увеличением a испытывает все большее притяжение со стороны полииона и
работа отрыва протона возрастает). Этот эффект существенно уменьшается при введении
в р-ры простых солей, экранирующих заряды полиионов. По мере увеличения концентрации
простых солей электрохим. поведение р-ров слабых П. приближается к поведению
низкомол. аналогов.
Для описания электрохим.
поведения П. пользуются значением "характеристич." константы диссоциации
К0, т.е. диссоциации единичной ионогенной группы в
отсутствие др. заряженных групп в цепи, к-рую получают экстраполяцией К.
к нулевому значению a, и производной "кажущейся"
Kкаж по a. Значения К0 и К для
соответствующего низкомол. аналога обычно близки, хотя они и не должны совпадать,
т. к. ионогенная группа в полимерной цепи находится в др; микроокружении. Изменение
Kкаж П. при изменении a определяется производной электростатич.
своб. энергии Gэл по а:
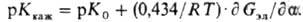
Для изучения силы полимерных
к-т и оснований не следует пользоваться определением рК как значением
рН в точке a = 0,5. Поскольку Gэл зависит от конформации
цепи, методы изучения
равновесия при диссоциации (потен-циометрич. титрование) широко используют для
определения Gэл и исследования термодинамики конформац.
превращений в р-рах П. (белков, нуклеиновых к-т, полисахаридов, полиметакриловой
к-ты и др.).
Равновесные свойства
растворов. Изучение равновесных с-в р-ров П. свидетельствует о существ.
отклонении их поведения от идеального. Так, осмотич. давление p бессолевых
р-ров П. значительно меньше, чем ожидаемое для идеальных р-ров (pид).
Мерой отклонения от идеального поведения служит величина осмотич. коэф. Фр
= p/pид, к-рая для высокомолекулярных П. не
зависит от их мол. массы и концентрации в р-ре, но заметно уменьшается при возрастании
линейной плотности заряда. Для типичных П. винилового ряда Фр ~ 0,1.
Главной причиной отклонения поведения р-ров П. от идеального считают влияние
сильного электрич. поля полииона на характер распределения противоионов. К таким
же выводам приводит анализ значений коэф. активности противоионов в р-рах П.
Совр. теории р-ров П. опираются
на представление о том, что при высокой линейной плотности заряда часть противоионов
должна "сконденсироваться" на полиионе, чтобы понизить плотность
заряда до нек-рой критич. величины. Последняя совпадает с обратной величиной
бьеррумовской длины e2/ekT (е-заряд протона,
e-диэлектрич. проницаемость р-рителя, k - постоянная Больцмана,
Т-абс. т-ра). Если отношение x = (e2/ekT)/b
больше единицы, то на полиионе должна "сконденсироваться" доля
противоионов, равная 1 — x-1, тогда x достигнет своего
критич. значения, равного единице; в противном случае система термодинамически
неустойчива (здесь b-проекция расстояния между соседними заряженными
группами полииона на ось полностью вытянутой цепи; x-безразмерный критич.
параметр). Поведение таких р-ров, а также р-ров, содержащих полиионы с низкой
плотностью заряда (x < 1), на к-рых конденсации противоионов не происходит,
описывается Дебая - Хюккеля теорией.
При изучении равновесных
св-в р-ров П. различают бессолевые р-ры и р-ры, содержащие дополнительно введенные
соли. В первом случае вклад собственно полиионов в равновесные (коллигативные)
св-ва р-ра П. пренебрежимо меньше, чем вклад большого кол-ва противоионов. Поэтому
бессолевые р-ры не используют для определения мол. масс П. Введением в р-ры
П. дополнит. кол-в солей удается, опираясь на аддитивность p в такой
тройной системе (p = = pп + p:с,
где pп - измеряемое осмотич. давление бессолевого р-ра П., pс-осмотич.
давление р-ра соли, не содержащего П.), выявить экспериментально вклад полиионов.
При исследовании мембранного равновесия в солевых р-рах П. обнаруживается т.
наз. доннановский эффект исключения соли. Он обусловлен установлением равновесного
распределения соли, при к-ром активности соли в ячейке, содержащей П., и в отделенной
от нее полупроницаемой мембранной ячейке, не содержащей П., совпадают. Отсюда
вытекает, что концентрация соли в первой ячейке меньше, чем во второй, т. е.
со ль действительно частично исключается из ячейки, содержащей П.; это относится
и к распределению соли в разб. р-ре П. между пространством, занятым звеньями
полииона, |и окружающим р-рителем. При увеличении концентрации соли доннановский
эффект ослабляется и при больших концентрациях им можно пренебречь.
Совр. теории р-ров П. позволяют
рассчитать электро-статич. потенциал в близи заряженного полииона и Gэл,
эквивалентную работе, совершаемой против электрич. сил при диссоциации П.,
имеющего заданное пространств. расположение ионогенных групп, т.е. заданную
конформацию. Большинство из этих теорий является распространением теории Дебая
-Хюккеля на многозарядные полионы. Характеристики рассчитывают для полиионов
определенной геом. формы, к-рые являются моделями реальных макромолекул. Так,
сферич. модели используют для предсказания св-в компактных полиионов, напр.
глобулярных белков, модели цилиндров и жестких стержней - для жестких макромолекул,
напр. нативной ДНК,
или для изучения равновесных свойств р-ров синтетических П. Разворачивание полиионов
анализируют в терминах моделей эквивалентных статистич. цепей.
П. обладают способностью
специфически связывать про-тивоионы (образование ионных пар между заряженными
группами П. и противоионами, ионных тройников и более сложных ионных комплексов).
Это явление не находит объяснения в рамках простых электростатич. теорий П.
и связано с особенностями строения ионогенных групп П. и гидратных оболочек
противоионов. Многие П. способны образовывать устойчивые комплексы с многозарядными
ионами и ионами переходных металлов.
Применение. П. используют
как флокулянты в процессах обогащения минер. сырья, в-ва для стабилизации буровых
жидкостей и повышения нефтеотдачи, стабилизаторы коллоидных систем в пищ. и
парфюм. пром-сти, ср-ва для снижения жесткости воды, добавки к ПАВ, для улучшения
св-в волокон и бумаги, для решения экологич. задач, напр. для очистки пром.
бытовых стоков; в медицине П.-эффективные физиологически активные соед., напр.
при конструировании высокоактивных искусств. антигенов и создании на их основе
вакцин. П. используют для получения полимер-полимерных комплексов.
Лит.: Тенфорд Ч.,
Физическая химия полимеров, пер. с англ., М., 1965; Энциклопедия полимеров,
т. 3, М., 1977, с. 89-101; Polyelectrolytes, ed. by Е. Selegny [а. о.], Dordrecht
Boston, 1974; Polyelectrolytes and their applications, ed. by A. Rembaum, E.
Selegny, Dordrecht - Boston, 1975. А.Б. Зезин


