РЕППЕ РЕАКЦИИ. 1)
Синтез карбоновых к-т и их производных взаимод. СО с разл. орг. соединениями
(в т.ч. с ненасыщ. углеводородами) и соединениями с подвижным атомом Н, напр.:
RC=CH + СО + НХ :
RCH=CHC(O)X 2RCH=CH2 + 2СО + 2НХ : RCH2CH2C(O)X
+ CH3CHRC(O)X
ROH + CO + HX : RC(O)X
+ H2O ROR' + CO + HX : RC(O)X + ROH X = HO,R:O,HS,R:S,R:COO,NHR:
P.p. относится к р-циям
карбонилирования. Ее осущест-вляют в присут. карбонилов металлов (обычно
карбонилы Со или Ni), к-рые служат катализаторами, а при их избытке-и источниками
СО. В зависимости от соотношении кол-ва используемых в р-ции карбонилов металлов
и реагентов различают два осн. способа ее проведения-"стехио-метрический"
и "каталитический". В первом способе карбонилы металлов и др. реагенты
берутся в стехиометрия, кол-вах; р-ция проходит при относительно низких давлениях
и т-рах: 5-10 МПа, 50-60 °С (ацетилены) и 160-170 °С (оле-фины). Во
втором способе карбонилы металлов берутся в небольших (каталитич.) кол-вах;
р-цию осуществляют с использованием стехиометрич. кол-в СО при давлении ок.
20 МПа и т-рах 150-180°С (для ацетиленов) и 180-200°С (для олефинов).
Карбонилирование ацетилена
приводит к акриловой к-те. Монозамещенные ацетилены обычно образуют один продукт,
дизамещенные-два возможных изомера:
СН3С=СН
+ СО + Н2О : СН2=С(СН3)СООН 2РhС=ССН3
+ 2СО + 2Н2O :PhCH=C(CH3)COOH + CH3CH=C(Ph)COOH
2RCH=CHR' + 2СО + 2Н2О
: RCH2CHR'COOH + + R'CH2CHRCOOH
При карбонилировании гем-дизамещенных
этилена доля триалкилуксусной к-ты не превышает, как правило, 15%:
RR'C=CH2 + СО
+ H2О : RR'CHCH2COOH + + CH3CRR'COOH
Селективность карбонилирования
сопряженных диенов значительно зависит от условий р-ции. Так, в р-ции 1,4-бута-диена
в присут. пиридина и Со2(СО)8 при 160-200°С и 25 МПа
образуется в осн. 4-пентеновая к-та:
СН2=СНСН=СН2
+ СО + Н2O : : СН2=СНСН2СН2СООН
При 210 °С и 43
МПа в этой же р-ции образуется смесь адипиновой НООС(СН2)4СООН,
a-метилглута-ровой НООССН(СН3)СН2СН2СООН,
этилянтарной HООССН(С2Н5)СН2СООН и валериановой
СН3(СН2)3СООН к-т.
При синтезе к-т и сложных
эфиров из олефинов и диенов высокую каталитич. активность проявляют комплексы
Pd2+. В условиях гомог. или гетерог. катализа они позволяют
смягчить условия проведения р-ции и повысить селективность процесса.
Карбонилирование метанола
до уксусной к-ты с использованием карбонилов Со или Ni происходит в очень жестких
условиях [в присут. Со2(СО)8 при 230 °С и 60 МПа].
В более мягких условиях (175°С, 3-4 МПа) р-ция осуществляется В присут.
кат. Паулика-Рота (карбонилиодидный комплекс Rh), к-рый используют для промышленного
произ-ва уксусной к-ты.
Многоатомные спирты карбонилируются
с образованием поликарбоновых к-т, напр.:
НО(СН2)4ОН
+ 2СО : НООС(СН2)4СООН
Фенолы в P.p. не вступают.
Карбонилированием тетра-гидрофурана получают адипиновую к-ту:
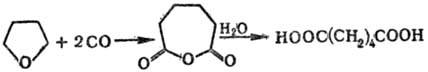
2) Синтез простых и сложных
виниловых эфиров, винил-сульфидов и виниламинов взаимод. ацетилена со спиртами,
фенолами, к-тами, меркаптанами и аминами в присут. основных катализаторов (щелочных
и щел.-зем. гидрокси-дов и алкоксидов, NaH, KCN и др.):
СН=СН + НХ :
ХСН=СН2 X = OR, OAr, RCOO, SR, NHR
Р-цию осуществляют при
150-200 °С и давлении до 4 МПа. Фенолы более реакционноспособны, чем спирты;
b-и g-непредельные спирты, как правило, не вйнилируются.
Третичные амины в условиях
Р. р. реагируют по схеме:
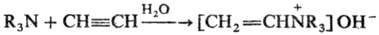
Механизм р-ции включает
стадию образования карба-ниона (В-основание):
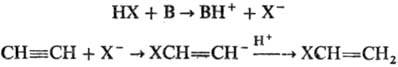
В условиях P.p., используя
в качестве катализаторов Zn-или Cd-соли карбоновых к-т, можно осуществить виншгиро-вание
b-дикарбонильных соед. (ацетилацетона, малонового и ацетоуксусного эфиров
и др.) и сложных эфиров. В присут. таких катализаторов фенолы подвергаются С-винилирова-нию.
3) Конденсация ацетилена
и его монозамещенных гомологов с альдегидами или кетонами (алкинолъный синтез),
аминами (аминобутиновый синтез) или a-гидроксиаминами (аминопропиновый
синтез) в присут. ацетиленидов Сu, Hg, Ag или Аu. Р-ЦИИ осуществляют обычно
при повыш. т-ре и давлении до 2 МПа.
Алкинольный синтез:
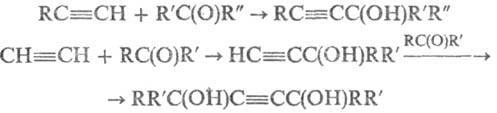
В случае альдегидов (R'
= Н) присоединение второй молекулы затрудняется с ростом длины углеводородной
цепи. Аминобутиновый синтез:
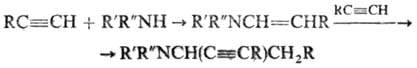
Аминопропиновый синтез:
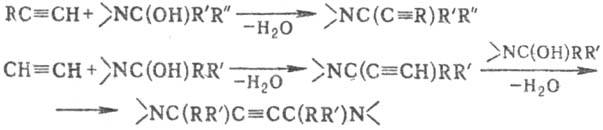
Вместо гидроксиаминов в
р-цию можно вводить амин (триалкиламин, пиперидин, морфолин и др,) и альдегид
(обычно СН2О).
4) Циклоолигомеризация
ацетилена и его гомологов с образованием бензола, циклооктатетраена и их производных,
а также циклополиолефинов более высокой мол. массы, напр.:
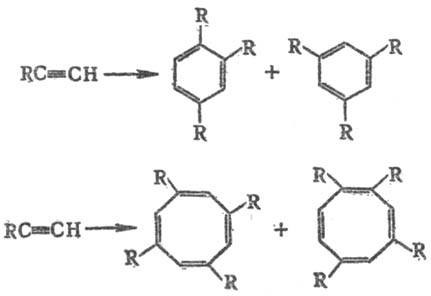
Р-цию осуществляют при
60-120 °С и 1,5-2,5 МПа в орг. р-рителе (бензоле, циклогексане, ТГФ, диоксане,
ДМФА и др.), кат.-Ni(CN)2, Ni(SCN)2, никелевые производные
b-дикарбонильных соед., комплексы типа Ni(CO3)3(MR3)
и Ni(CO)2(MR3)2, где М = P, As и
Sb, R = Alk, Аr. Высокую активность при циклотримеризации проявляют монозаме-щенные
алкины с R = Alk, Ar, СН=СН2, OR', NR'2, C(O)R', ОН и
COOR', мало активны алкины с R = СООН, CN, C(O)NH2. Селективность
циклотримеризации зависит от природы катализатора. Циклотримеризацию дизамещенных
алкинов можно осуществить в присут. Fe(CO)2, Co2(CO)8
и Hg[Co(CO4)]2. Циклооктатетраен с большим выходом
образуется при проведении р-ции в ТГФ в присут. Ni(CN)2. P.p. лежат
в основе мн. пром. процессов, в т.ч. крупнотоннажных, позволяющих получать разнообразные
хим. в-ва. Они разработаны В. Реппе в 1930-50.
Лит.: Houben-Weyl, Methoden der Organischen Chemie, B3 4, Tl 2, Stuttg., 1955, S. 407, 413; там же, Bd 6, Tl 2, S. 664. См. также лит. при ст. Карбони-лирование. А. А. Соловьяное.


