СИНИЛЬНАЯ КИСЛОТА
(цианистый водород, нитрил муравьиной к-ты) HCN, бесцв. подвижная жидкость с
запахом горького миндаля. Молекула линейна, длина связи С—H 0,1064 нм,
C=N 0,1156 нм, m 9,92·10-30 Кл·м (газ); т. пл. -13,29°С,
т. кип. 25,65°С; 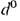 0,71618,
0,71618,
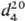 0,687.08;
0,687.08; 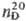 1,26136; tкрит 183,5 °С, dкрит 0,195
г/см3, pкрит 4,95 МПа; для газа
1,26136; tкрит 183,5 °С, dкрит 0,195
г/см3, pкрит 4,95 МПа; для газа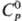 35,86
Дж/(моль·К),
35,86
Дж/(моль·К), 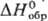 132 кДж/моль,
132 кДж/моль,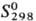 201,71 Дж/(моль·К);
DHсгор -663 кДж/моль, DHпл 8,41
кДж/моль, DHисп 25,2 кДж/моль; ур-ния температурной зависимости
давления пара: lgp(мм рт. ст.) = 9,372 — 1877/Г (187-259 К), lgp(MM
рт. ст.) = 7,795-1467/T (273-319 К); g 17,78 мН/м; h 0,183
мПа·с; e 106,8; r 105 Ом·м. Существует в двух кристаллич.
модификациях: ниже — 102,78 °С- в ромбической (а = 0,413 нм, b
= 0,485 нм, с = 0,434 нм, z = 2, пространств. группа I2mm),
выше этой т-ры-в тетрагональной (а = 0,463 нм, с = 0,434 нм, z
= 2, пространств. группа I4mm). В жидком виде и в р-ре образует
линейные ассоциаты благодаря водородным связям N... Н. Смешивается с водой и
мн. орг. р-рителями (спирты, эфиры, ароматич. углеводороды, ССl4
и др.).
201,71 Дж/(моль·К);
DHсгор -663 кДж/моль, DHпл 8,41
кДж/моль, DHисп 25,2 кДж/моль; ур-ния температурной зависимости
давления пара: lgp(мм рт. ст.) = 9,372 — 1877/Г (187-259 К), lgp(MM
рт. ст.) = 7,795-1467/T (273-319 К); g 17,78 мН/м; h 0,183
мПа·с; e 106,8; r 105 Ом·м. Существует в двух кристаллич.
модификациях: ниже — 102,78 °С- в ромбической (а = 0,413 нм, b
= 0,485 нм, с = 0,434 нм, z = 2, пространств. группа I2mm),
выше этой т-ры-в тетрагональной (а = 0,463 нм, с = 0,434 нм, z
= 2, пространств. группа I4mm). В жидком виде и в р-ре образует
линейные ассоциаты благодаря водородным связям N... Н. Смешивается с водой и
мн. орг. р-рителями (спирты, эфиры, ароматич. углеводороды, ССl4
и др.).
С.к.-слабая к-та, К
= 1,32·10-9 (18°С), образует с металлами соли-цианиды.
Для С. к. характерны р-ции:
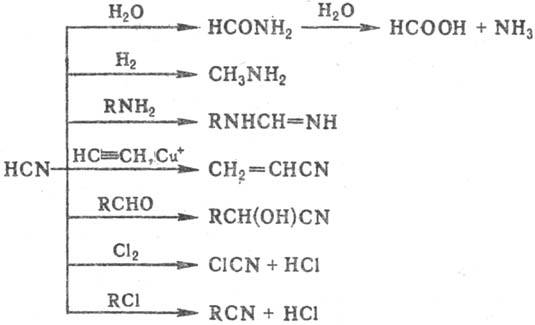
Взаимод. с оксидами и гидроксидами
щелочных и щел.-зем. металлов, не реагирует с их карбонатами. В присут. оснований
С. к. полимеризуется, стабилизаторы-Н3РО4, H2SO4.
Образует аддукты, напр. HCN-CuCl.
Осн. пром. метод получения
С.к.-окислит. аммонолиз смеси NH3 и СН4 в присут. Pt или
Pt - Rh, Pt-Ir при 1000 °С:
СН4 + NH3
+ 1,5О2 : HCN + 3Н2О + 474,5 кДж/моль
Используют также аммонолиз
СО, дегидратацию форма-мида, разложение цианплава разб. H2SO4.
В лаборатории С. к. получают постепенным добавлением водного р-ра NaCN, K4[Fe(CN)6]
к разб. H2SO4 при 20-30 °С с послед. конденсацией
HCN.
В своб. и связанном виде
С. к. встречается в растениях, чаще всего в виде гликозида амигдалина, содержится
в коксовом газе, табачном дыме, образуется при термич. разложении найлона, полиуретанов
и др.
Применяют С. к. в произ-ве
цианидов, хлорциана, акрило-нитрила, адиподинитрила, акрилатов, аминокислот,
гид-роксинитрилов, как фумигант.
С. к. горюча и взрывоопасна,
т. всп. — 18 °С, КПВ 4,9-39,7%, т. самовоспл. паров в воздухе 538 °С.
Сильно токсична, задерживает окислит. и ферментативные процессы, связывает гемоглобин
в циангемоглобин, парализует дыхат. центр и вызывает удушье; проникает через
неповрежденную кожу; ПДК 0,3 мг/м3 в воздухе рабочей зоны, 0,01 мг/м3
в атм. воздухе, 0,1 мг/л в воде.
Мировое произ-во св. 0,5
млн. т/год (1987).
Лит.: Бобков С.
С., Смирнов С. К., Синильная кислота, М., 1970.
С. К. Смирнов.


