СКРАУПА РЕАКЦИЯ
(Скраупа синтез), получение хи-нолинов взаимод. первичных ароматич. аминов с
глицерином в присут. дегидратирующего агента и окислителя:
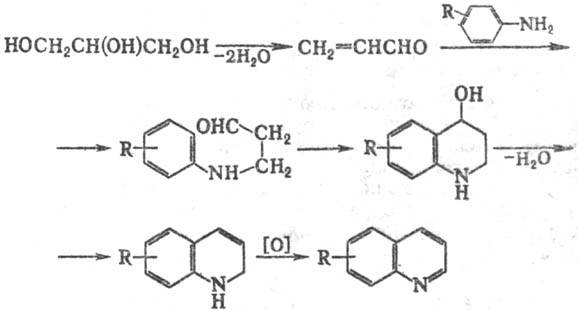
В качестве дегидратирующего
агента используют Н2SO4 (концентрация 60-70%), в качестве
окислителя-обычно ArNO2 с Аг как у исходного амина.(применяют также
I2, FeCl3, SnCl4, м-O2NC6H4SO3H
и др.). Добавление в реакц. смесь FeSO4, CH3COOH, а также
замена ароматич. амина на соответствующий ацетамид обеспечивают регулируемость
процесса, к-рый в нек-рых случаях протекает бурно.
Замена глицерина непосредственно
на акролеин обычно приводит к значит. осмолению продуктов. Однако замещенные
производные акролеина и их ацетали, винилкетоны, и соед., образующие их в условиях
р-ции, реагируют по схеме С. р., напр.:
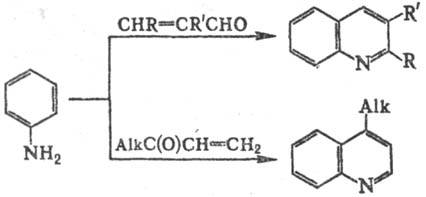
В р-цию вступают мн. замещенные
ароматич. амины [лишь такие заместители, как СН3С(О), СН3О,
CN, F в нек-рых случаях в условиях С. р. отщепляются]. Мо-но-орто-замещенные
анилины обычно образуют 8-замещен-ные хинолины, пара-замещенные - хинолины
с заместителем в положении 6. мета-Замещенные анилины образуют 5- и(или)
7-замещенные хинолины. При этом дезактивирующие и мета-ориентирующие
заместители (напр., NO2) благоприятствуют замыканию цикла по положению
2 с образованием 5-замещенных хинолинов; сильные активирующие и орто(пара)-ориентирующие
группы (напр., ОСН3) способствуют замыканию цикла по положению 6
с образованием 7-замещенных хинолинов. В остальных случаях образуются смеси
изомеров. Соотношение изомерных хинолинов иногда зависит от концентрации к-ты.
Так, в присут. 60%-ной H2SO4 м-хлоранилин образует
смесь 5-и 7-хлорхинолинов в соотношении 1:1,4, а с 80%-ной-в соотношении 1:3,9.
Ди-орто-замещенные
анилины не вступают в С. р. Из 3,4-дизамещенных анилинов образуются два изомерных
хинолина, причем наличие ориентантов 1-го рода благоприятствует образованию
6,7-производных. Ароматич. диамины реагируют с двумя эквивалентами глицерина
с образованием фенантролинов.
Аминопроизводные нафталина,
антрацена, фенантрена и др. конденсированных ароматич. соед. в условиях С. р.
образуют т. наз. арохинолины [напр., 1-нафтиламин образует бензо[h]хинолин
(ф-ла I), 2-нафтиламин-бензо[f]хи-нолнн (II)]:
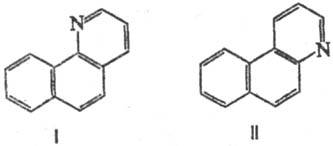
Стремление к замыканию
кольца по положению 1 настолько сильно, что галоген или группа NO2
в положении 1 в 2-нафтиламинах отщепляются в ходе р-ции (в результате образуются
арохинолины ф-лы I).
В условиях С. р. аминопроизводные
ряда тиофена, фурана и пиридина частично разлагаются и обычно дают низкие выходы
соответствующих; конденсир. гетероциклич. систем, напр.:
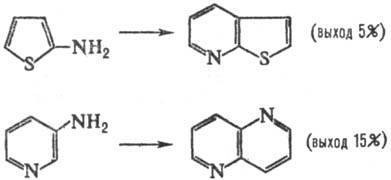
Обычно С. р. осуществляют,
нагревая смесь реагентов в течение неск. часов (реже - минут). Затем смесь охлаждают,
приливают воду (иногда водный р-р NaOH), выделяют конечный продукт перегонкой
с водяным паром. Выходы 40-90%. Осн. побочные продукты-смолы, продукты гидролиза
замещенных ароматич. аминов, изомерные конденсир. системы.
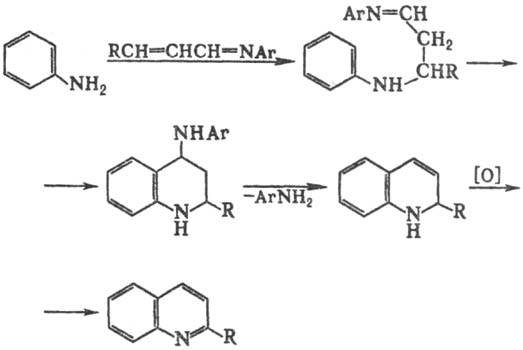
Одна из модификаций С.
р.-использование основания Шиффа; в этом случае замыкание цикла сопровождается
элиминированием амина вместо Н2О:
Синтез хинолинов из ароматич.
аминов и глицерина в среде 85%-ной Н3РO4 наз. модификацией
Йейла.
С. р. широко используют
в препаративной практике, для получения фармацевтич. препаратов, фотосенсибилизаторов
и др. Р-ция открыта 3. Скраупом в 1880.
Лит.: Манске Р.,
Кулка М., в сб.: Органические реакции, пер. с англ., сб. 7, М., 1956, с. 100-145;
Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 198-201. Г. И.
Дрозд.


