СОЛЯНАЯ КИСЛОТА
(хлористоводородная к-та, хлороводородная к-та), р-р НС1 в воде-бесцв. жидкость
с резким запахом; рильная одноосновная кислота. Хлористый водород НС1 (мол.
м. 36,461 )-бесцв. газ с резким запахом, во влажном воздухе сильно дымит; длина
связи H—С1 0,1274 нм, m 3,716·10-30 Кл·м, энергия диссоциации
427,77 кДж/моль; т. кип. —85,1 °С (бесцв. легко подвижная жидкость), т.
пл. —114,22 °С; кристаллизуется в кубич. решетке, ниже —174,15 °С существует
ромбич. модификация; тройная точка —114,22 °С; плотн. по воздуху 1,2679;
Гкрнт 51,4°С, pкрит 8,258 МПа, dкрит
0,42 г/см3;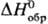 -92,31 кДж/моль, DHпл 1,9924 кДж/моль (-114,22°С),
DHисп 16,1421 кДж/моль (-8,05°С);
-92,31 кДж/моль, DHпл 1,9924 кДж/моль (-114,22°С),
DHисп 16,1421 кДж/моль (-8,05°С);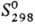 186,79
Дж/(моль·К); давление пара (Па): 133,32·10-6 (-200,7°С), 2,775·103
(-130,15°С), 10,0·104 (-85,1 °С), 74,0·104
(-40°С), 24,95 · 105 (О °С), 76,9 · 105 (50 °С);
ур-ние температурной зависимости давления пара lgp(кПа) = -905,53/Т+
1,75lgT— -500,77·10-5T+3,78229 (160-260 К); коэф. сжимаемости
0,00787; g 23 мН/см (-155°С); r 0,29·107 Ом·м (-85°С),
0,59·107 (-114,22°С). См. также табл. 1.
186,79
Дж/(моль·К); давление пара (Па): 133,32·10-6 (-200,7°С), 2,775·103
(-130,15°С), 10,0·104 (-85,1 °С), 74,0·104
(-40°С), 24,95 · 105 (О °С), 76,9 · 105 (50 °С);
ур-ние температурной зависимости давления пара lgp(кПа) = -905,53/Т+
1,75lgT— -500,77·10-5T+3,78229 (160-260 К); коэф. сжимаемости
0,00787; g 23 мН/см (-155°С); r 0,29·107 Ом·м (-85°С),
0,59·107 (-114,22°С). См. также табл. 1.

Р-римость НС1 в углеводородах
при 25 °С и 0,1 МПа (мол. %): в пентане-0,47, гексане-1,12, гептане-1,47,
октане-1,63. Р-римость НС1 в алкил- и арилгалогенидах невелика, напр. 0,07 моль/моль
для С4Н9С1. Р-римость в интервале от —20 до 60° С
уменьшается в ряду дихлорэтан-три-хлорэтан-тетрахлорэтан-трихлорэтилен. Р-римость
при 10°С в ряде спиртов составляет примерно 1 моль/моль спирта, в эфирах
карбоновых к-т 0,6 моль/моль, в карбо-новых к-тах 0,2 моль/моль. В простых эфирах
образуются устойчивые аддукты R2O · НСl. Р-римость НС1 в расплавах
хлоридов подчиняется закону Генри и составляет для КСl 2,51·10-4
(800°С), 1,75·10-4 моль/моль (900°С), для NaCl 1,90·10-4
моль/моль (900 °С).
Соляная к-та. Растворение
НСl в воде-сильно экзо-термич. процесс, для бесконечно разб. водного р-ра DH0
растворения НСl —69,9 кДж/моль, 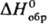 иона Сl-—
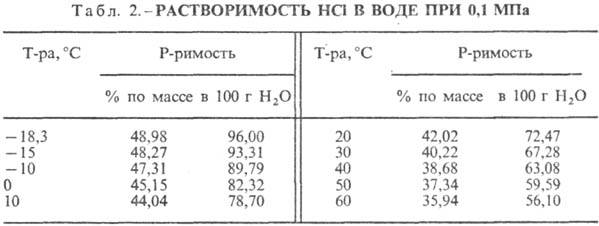
167,080 кДж/моль; НС1 в воде полностью ионизирован. Р-римость НС1 в воде зависит
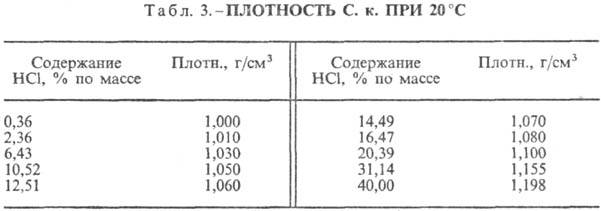
от т-ры (табл. 2) и парциального давления НС1 в газовой смеси. Плотность С.
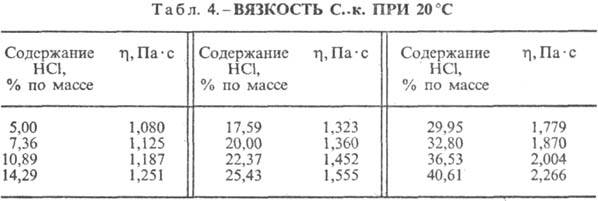
к. разл. концентрации и h при 20 °С представлены в табл. 3 и 4. С повышением
т-ры h С. к. понижается, напр.: для 23,05%-ной С. к. при 25 °С h
1364мПа·с, при 35 °С 1,170 мПа·с.
иона Сl-—
167,080 кДж/моль; НС1 в воде полностью ионизирован. Р-римость НС1 в воде зависит
от т-ры (табл. 2) и парциального давления НС1 в газовой смеси. Плотность С.
к. разл. концентрации и h при 20 °С представлены в табл. 3 и 4. С повышением
т-ры h С. к. понижается, напр.: для 23,05%-ной С. к. при 25 °С h
1364мПа·с, при 35 °С 1,170 мПа·с.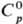 С.
к., содержащей h молей воды на 1 моль НС1, составляет [кДж/(кг·К)]:
3,136 (п = 10), 3,580 (п = 20), 3,902 (п =50), 4,036 (n
= 100), 4,061 (п = 200).
С.
к., содержащей h молей воды на 1 моль НС1, составляет [кДж/(кг·К)]:
3,136 (п = 10), 3,580 (п = 20), 3,902 (п =50), 4,036 (n
= 100), 4,061 (п = 200).
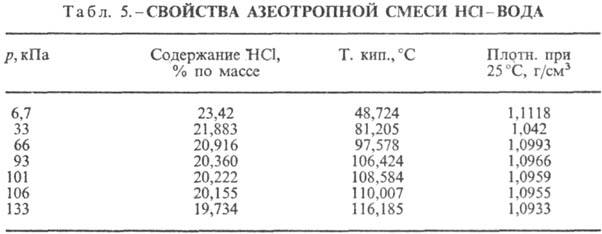
НС1 образует с водой азеотропную
смесь (табл. 5). В системе HCl-вода существует три эвтектич. точки: — 74,7 °С
(23,0% по массе НСl); -73,0°С (26,5% НСl); -87,5°С (24,8% НС1, метастабильная
фаза). Известны кристаллогидраты НСl·nН2О, где n =
8, 6 (т. пл. -40 °С), 4, 3 (т. пл. -24,4°С), 2 (т. пл. -17,7°С)
и 1 (т. пл. -15,35°С). Лед кристаллизуется из 10%-ной С. к. при —20, из
15%-ной-при -30, из 20%-ной-при -60 и из 24%-ной-при -80°С. Р-римость галогенидов
металлов с увеличением концентрации НС1 в С. к. падает, что используют для их
высаливания.
Химические свойства. Чистый
сухой НСl начинает диссоциировать выше 1500°С, химически пассивен. Мн. металлы,
С, S, P не взаимод. даже с жидким НС1. С нитридами, карбидами, боридами,
сульфидами реагирует выше 650 °С, с гидридами Si, Ge и В-в присут. АlСl3,
с оксидами переходных металлов-при 300 °С и выше. Окисляется О2
и HNO3 до Сl2, с SO3 дает C1SO3H.
О р-циях с орг. соединениями см. Гидрогалогенирование.
С. к. химически
весьма активна. Растворяет с выделением Н2 все металлы, имеющие отрицат.
нормальный потенциал, со
мн. оксидами и гидроксидами металлов образует хлориды, выделяет своб. к-ты из
таких солей, как фосфаты, силикаты, бораты и др.
Получение. В пром-сти
НС1 получают след. способами-сульфатным, синтетич. и из абгазов (побочных газов)
ряда процессов. Первые два метода теряют свое значение. Так, в США в 1965 доля
абгазной С. к. составляла 77,6% в общем объеме произ-ва, а в 1982-94%.
Произ-во С. к. (реактивной,
полученной сульфатным способом, синтетич., абгазной) заключается в получении
НС1 с послед. его абсорбцией водой. В зависимости от способа отвода теплоты
абсорбции (достигает 72,8 кДж/моль) процессы разделяются на изотермич., адиабатич.
и комбинированные.
Сульфатный метод основан
на взаимод. NaCl с конц. H2SO4 при 500-550 °С. Реакц.
газы содержат от 50-65% НС1 (муфельные печи) до 5% НСl (реактор с кипящим слоем).
Предложено заменить H2SO4 смесью SO2 и О2
(т-ра процесса ок. 540 °С, кат.-Fе2О3).
В основе прямого синтеза
НС1 лежит цепная р-ция горения: Н2
+ Сl2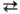 2НСl+184,7кДж
Константа равновесия Кр рассчитывается по ур-нию: lgKp
= 9554/T- 0,5331g T+ 2,42.
2НСl+184,7кДж
Константа равновесия Кр рассчитывается по ур-нию: lgKp
= 9554/T- 0,5331g T+ 2,42.
Р-ция инициируется светом,
влагой, твердыми пористыми (древесный уголь, пористая Pt) и нек-рыми минер.
в-вами (кварц, глина). Синтез, ведут с избытком Н2 (5-10%) в камерах
сжигания, выполненных из стали, графита, кварца, огнеупорного кирпича. Наиб.
совр. материал, предотвращающий загрязнение НСl,-графит, импрегнированный фе-ноло-формальд.
смолами. Для предотвращения взрывного характера горения реагенты смешивают непосредственно
в факеле пламени горелки. В верх. зоне камер сжигания устанавливают теплообменники
для охлаждения реакц. газов до 150-160°С. Мощность совр. графитовых печей
достигает 65 т/сут (в пересчете на 35%-ную С. к.). В случае дефицита Н2
применяют разл. модификации процесса; напр., пропускают смесь С12
с водяным паром через слой пористого раскаленного угля:
2Сl2 + 2Н2О
+ С : 4НС1 + СО2 + 288,9 кДж
Т-ра процесса (1000-1600
°С) зависит от типа угля и наличия в нем примесей, являющихся катализаторами
(напр., Fe2O3). Перспективно использование смеси СО с
парами воды:
СО + Н2О + Сl2
: 2НС1 + СО2
Более 90% С. к. в развитых
странах получают из абгаз-ного НС1, образующегося при хлорировании и дегидрохло-рировании
орг. соединений, пиролизе хлорорг. отходов, хлоридов металлов, получении калийных
нехлорир. удобрений и др. Абгазы содержат разл. кол-ва НС1, инертные примеси
(N2, H2, СН4), малорастворимые в воде орг.
в-ва (хлорбензол, хлорметаны), водорастворимые в-ва (уксусная к-та, хлораль),
кислые примеси (Сl2, HF, О2) и воду. Применение изотермич.
абсорбции целесообразно при низком содержании НС1 в абгазах (но при содержании
инертных примесей менее 40%). Наиб. перспективны пленочные абсорберы, позволяющие
извлекать из исходного абгаза от 65 до 85% НС1.
Наиб. широко применяют
схемы адиабатич. абсорбции. Абгазы вводят в ниж. часть абсорбера, а воду (или
разбавленную С. к.)-противотоком в верхнюю. С. к. нагревается до т-ры кипения
благодаря теплоте растворения НСl. Изменение т-ры абсорбции и концентрации НС1
дано на рис. 1. Т-ра абсорбции определяется т-рой кипения к-ты соответствующей
концентрации (макс. т-ра-т. кип. азеотропной смеси-ок. 110°С).
На рис. 2 дана типовая
схема адиабатич. абсорбции НС1 из абгазов, образующихся при хлорировании (напр.,
получение хлорбензола). НСl поглощается в абсорбере 1, а остатки малорастворимых
в воде орг. в-в отделяют от воды после конденсации в аппарате 2, доочищают в
хвостовой колонне 4 и сепараторах 3, 5 и получают товарную С. к.
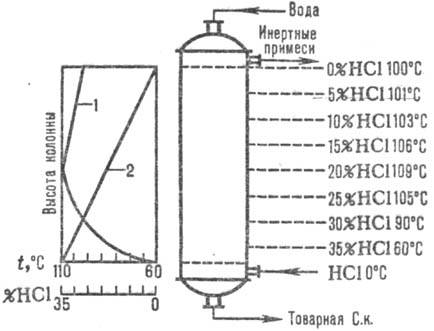
Рис. 1. Схема распределения
т-р (кривая 1) и концентрации (кривая 2) НСl по высоте адиабатич. абсорбера.
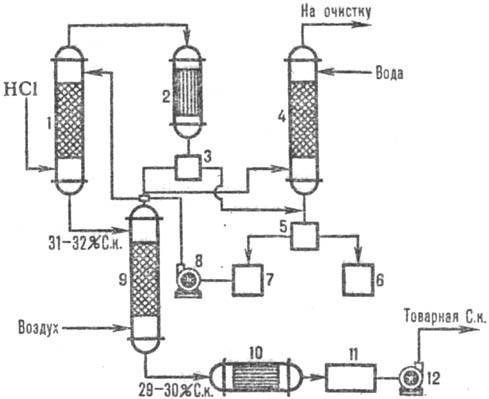
Рис.2. Схема типовой адиабатич.
абсорбции НСl из абгазов: 1-адиабатич. абсорбер; 2 - конденсатор; 3, 5-сепараторы;
4-хвостовая колонна; 6-сборник орг. фазы; 7-сборник водной фазы; 8, 12-насосы;
9-отдувочная колонна; 10-теплообменник; 11-сборник товарной к-ты.
На рис. 3 дана типовая
схема получения С. к. из абгазов с использованием комбинир. схемы абсорбции.
В колонне адиабатич. абсорбции получают С. к. пониж. концентрации, но свободную
от орг. примесей С. к. с повыш. концентрацией НСl производят в колонне изотермич.
абсорбции при пониж. т-рах. Степень извлечения НС1 из абгазов95-99% (при использовании
в качестве абсорбента разб. к-т) и практически полная-при использовании чистой
воды.
Рис. 3. Схема типовой комбинир.
абсорбции НС1 из абгазов: 1 - колонна адиабатич. абсорбции; 2 - конденсатор;
3-отделитель газов; 4-сепаратор; 5-холодильник; 6, 9-сборники к-ты; 7-насосы;
8-изотермич. абсорбер.
Определяют НС1 в воздухе
нефелометрически с образованием AgCl.
С. к. применяют для получения
хлоридов Mn, Fe, Zn и др., для травления металлов, очистки пов-стей сосудов,
скважин от карбонатов, обработки руд, при произ-ве каучуков, глу-тамината Na,
соды, Сl2 и т. д. Потребление С. к. в Японии (тыс. т); хим. пром-сть
320,7, произ-во глутамината Na 99,8, произ-во соды 54,8, черная металлургия
50,0, целлюлозно-бумажная пром-сть 22,2, прочие 80. НС1 используют для
регенерации Сl2, в орг. синтезе (получение винилхлорида, алкилхлоридов
и т.д.), как катализатор (напр., при получении дифенилолпропана, алкилирование
бензола).
Произ-во 31%-ной С. к.
в СССР 1,52 млн. т (1986). НС1
и С. к. токсичны, вызывают сильные ожоги слизистых оболочек, удушье, разрушают
зубы и т.д. ПДК НС1 в воздухе рабочей зоны 5,0 мг/м3.
Лит.: Якименко Л.
М., Пасманик М. И., Справочник по производству хлора, каустической соды и основных
хлорпродуктов, 2 изд., М., 1976; Левинский М. И., Мазанко А. Ф., Новиков И.
Н., Хлористый водород и соляная кислота, М., 1985. А. И. Торубаров.


