ТЕТРАГИДРОФУРАН (тетраметиленоксид,
ТГФ), мол.м. 72,1;
бесцв. жидкость с эфирным запахом; т.пл. — 108,5 °С, т. кип. 65,6-66,0 °С;
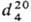 0,8886;
0,8886; 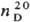 1,4068; m 5,70 x
10-30Кл·м; смешивается со многими орг. р-рителями и с водой; образует
азеотропы с водой (т. кип. 64 °С,
1,4068; m 5,70 x
10-30Кл·м; смешивается со многими орг. р-рителями и с водой; образует
азеотропы с водой (т. кип. 64 °С,  6% по массе воды) и гексаном (т. кил. 63 °С, 53,5% гексана).
6% по массе воды) и гексаном (т. кил. 63 °С, 53,5% гексана).
Для Т. характерны р-ции
раскрытия цикла под действием разл. агентов, напр.:
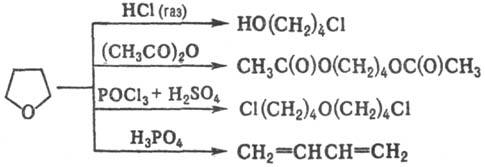 ·
·
Раскрытие цикла иногда
сопровождается полимеризацией, напр.: в присут. SOCl2 + FeCl3
при 0-5°С образуется полимер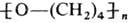 с
мол.м. 10-12 тью. В присут. катализаторов полимеризации (к-ты Льюиса, спирты,
щелочи и др.) Т. сополимеризуется с оксидами олефинов, напр.: с про-пиленоксидом
образуется полимер
с
мол.м. 10-12 тью. В присут. катализаторов полимеризации (к-ты Льюиса, спирты,
щелочи и др.) Т. сополимеризуется с оксидами олефинов, напр.: с про-пиленоксидом
образуется полимер
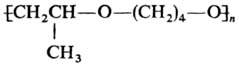
Хлорирование Т. Сl2
при 0°С или SO2Cl2 при 55-60°С приводит к 2,3-дихлортетрагидрофурану
(выход 65-90%). Жидкофазное окисление О2 воздуха в присут. пероксидов,
солей переходных металлов или В2О3 протекает с образованием
2-гидрокситетрагидрофурана (выход 15-17%) и g-бутиролактона (75-80%), окисление
Т. конц. HNO3-c образованием янтарной к-ты (выход 90%):
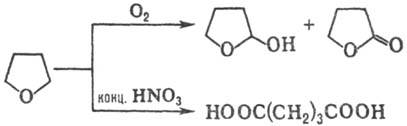
При пропускании над А12О3
в смеси с NH3 (300-350°C), H2S (400-450 °С) или
H2Se (400 °С) Т. превращ. соотв. в пирролидин, тиофан или селенофан.
Осн. пром. методы получения
Т.
1) Декарбонилирование фурфурола
с послед. гидрированием образующегося фурана:
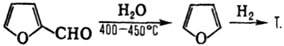
Катализатор первой стадии
- Cu(CrO2)2 или Сu-Аl, Cu-Cr-Al, второй-скелетный Ni с
добавками Сr (условия р-ции: 80-160°С, 2-10 МПа), Ni/Cr2O3
(100-180°C, 9-11 МПа, выход 97-99%), реже-Os или Pd.
2) Синтез по Реппе реакции:
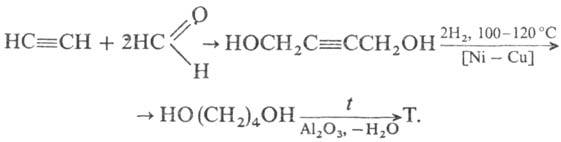
3) Гидрирование малеинового
ангидрида или эфиров ма-леиновой к-ты, напр.:
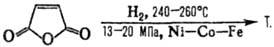
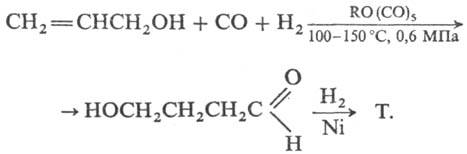
4) Гидрокарбонилирование
аллилового спирта с послед. гидрированием промежут. w-гидроксимасляного
альдегида:
Т.-р-ритель эфиров целлюлозы,
алкидных смол, СК, ПВХ, металлоорг. соед. и др.; сырье для получения синте-тич.
смол. Полимеры Т. и его сополимеры с этилен- и про-пиленоксидами-синтетич. смазочные
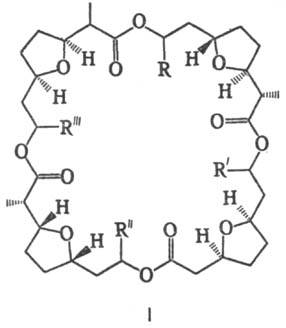
масла, сырье для получения уретановых эластомеров. Т.-структурный фрагмент нек-рых
антибиотиков, в т.ч. нактинов (ф-ла I, R-R:' = = Аlк)-макролидных антибиотиков,
продуцируемых акти-номицетами рода Streptomyces, с помощью к-рых. в организме
осуществляется транспорт ионов К через клеточные мембраны.
Для Т. т. всп. -20°С,
т. воспл. 250 °С, КПВ 1,84-11,8%. Т. раздражает слизистые оболочки, всасывается
через кожу, вызывает у животных поражение печени и почек; ЛД50 2,3
г/кг (мыши или морские свинки, внутрижелудоч-но); ПДК 100 мг/м3.
Лит.: Пономарев
А. А., Синтезы и реакции фурановых веществ, Саратов, 1960; Успехи химии фурана,
под ред. Э. Я. Лукевица, Рига, 1978; Контактные реакции фурановых соединений,
под ред. М. В. Шиманской, Рига, 1985; Plas H. С. van der, Ring transformations
of heterocycles, v. 1-2, L.-N. Y., 1973; Pajda E., Kwasnicki Z., Weber K., "Chemik",
1977, t. 30, №. 3, s. 67-73; Chemistry of ethers, crown ether, hydroxy groups
and their sulfur analogues, ed. by S. Patai, pt 1-2, Chichester, 1980. P.
А. Караханов, В.И. Келарев.


