УРОНОВЫЕ КИСЛОТЫ, моносахариды
(альдозы), молекулы к-рых вместо первичной спиртовой группы содержат карбоксильную.
Назв. У. к. производят от назв. соответствующих альдоз путем прибавления к корню
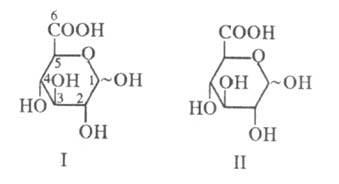
окончания "уроновая к-та" [напр., D-глюкуроновая к-та (ф-ла I),
D-галактуроновая к-та(II)].
У. к. широко распространены
в природе. Наиб. часто встречается D-глюкуроновая к-та, найденная в составе
мн. растит. гликозидов и полисахаридов (камеди, гемицеллюлозы; в последнем случае
вместе с 4-О-метил-О-глюкуроновой к-той). Разл. токсичные в-ва часто выводятся
из животных организмов с мочой в виде гликозидов D-глюкуроновой к-ты. D-Галактуроновая
к-та известна как главный компонент пектинов высших растений. D-Маннуроновая
и L-гулуроновая к-ты -компоненты альгиновых кислот бурых водорослей;
L-идуро-новая к-та вместе с D-глюкуроновой входит в состав мукопо-лисахаридов
животных тканей. Многие из перечисленных K-T и ряд более редких У. к., в
т. ч. 2-амино- и 2,3-диаминоуро-новые к-ты, обнаружены в составе бактериальных
полисаха-ридов.
У. к.- кристаллич. или
аморфные твердые в-ва; нелетучие, относительно высокоплавки; раств. в воде и
сильнополярных орг. р-рителях, не раств. в малополярных р-рителях.
Хим. св-ва У. к. аналогичны
св-вам моносахаридов; отличия обусловлены присутствием в молекуле группы COOH,
в результате чего У. к. могут давать соли и лактоны. Легкость лактони-зации
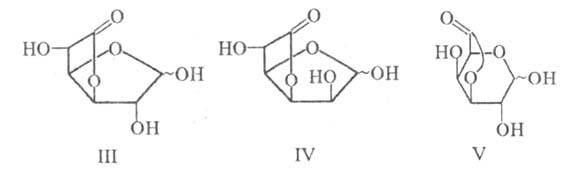
и структура лактона определяются природой исходной У. к. Так, D-глюкуроновая
и D-маннуроновая к-ты самопроизвольно превращаются в 3,6-лактоны (Ш и IV), в
к-рых моноса-харид имеет фуранозную форму; D-галактуроновая к-та самопроизвольно
не лактонизуется, а получаемый из нее в кислых условиях 3,6-лактон имеет пиранозную
форму (V).
При нагр. с сильными минер.
к-тами У. к. претерпевают дегидратацию и декарбоксилирование; образующийся при
дегидратации 5-карбоксифурфурол дает цветные р-ции с карбазолом, 3,5-диметилфенолом
или 3-гидроксидифенилом, что используют для спектрофотометрич. определения У.
к.
Гликозидные связи, образованные
У. к., как правило, приблизительно в 100 раз более устойчивы к действию разб.
к-т, чем гликозидные связи, образованные обычными моносаха-ридами. Это позволяет
при частичном гидролизе олиго- и полисахаридов, содержащих У. к., получать дисахариды
с остатком У. к. на невосстанавливающем конце (т. наз. а л ь -добиуроновые к-ты),
а из растит. гликозидов, содержащих олигос ах аридную цепь, к-рая начинается
остатком D-глюкуроновой к-ты,- т. наз. p r о г е н и н ы, т. е. гликозиды
упрощенной структуры, состоящие из агликона и D-глюкуроновой к-ты.
Заместитель в -положении
к карбоксильной группе У. к. (напр., группа ОН или RO) способен отщепляться
под действием оснований с образованием
-положении
к карбоксильной группе У. к. (напр., группа ОН или RO) способен отщепляться
под действием оснований с образованием  непредельных
производных, причем легкость осуществления р-ции сильно зависит от природы У.
к. (производные D-галактуроновой к-ты реагируют много легче производных D-глюкуроновой
к-ты) и наличия заряда на карбоксиле (эфиры к-т реагируют много легче, чем их
соли).
непредельных
производных, причем легкость осуществления р-ции сильно зависит от природы У.
к. (производные D-галактуроновой к-ты реагируют много легче производных D-глюкуроновой
к-ты) и наличия заряда на карбоксиле (эфиры к-т реагируют много легче, чем их
соли).
У. к. получают из прир.
источников (напр., D-галактуроно-вую к-ту - гидролизом пектинов в присут. фермента
полига-лактуроназы из грибов, D-маннуроновую и L-гулуроновую к-ты - кислотным
гидролизом альгинатов) или хим. синтезом, к-рый заключается в действии сильных
окислителей (напр., KMnO4) на защищенные производные альдоз, содержащие
своб. первичную группу ОН, с последующим удалением защитных группировок.
Лит.: Химия углеводов,
M., 1967. А. И. Усов.


