ФОТОЭЛЕКТРОХИМИЯ, изучает
процессы взаимного преобразования световой и электрич. энергии в системе электрод
- электролит. Наиб. распространены процессы преобразования энергии света в хим.
и электрич. энергию, сопровождающиеся протеканием фототока в цепи освещаемой
элект-рохим. ячейки, т.е. фотоэлектрохим. р-ции. Обратный процесс - испускание
света при прохождении электрич. тока через ячейку - может иметь природу электрохемилюминес-ценции,
газового разряда в зазоре между электродом и электролитом и т. д. В широком
смысле Ф. включает описание любых изменений на границе раздела электрод - электролит
при освещении, в т. ч. и в отсутствие тока, напр. возникновения фотопотенциала
и фотоемкости идеально поляризуемого электрода (см. Двойной электрический
слой).
Протекание фототока в электрохим.
цепи м. б. вызвано фотовозбуждением электрода или р-ра электролита. При поглощении
квантов света образуются первичные возбужденные состояния электронов, ионов
или молекул, обычно ко-роткоживущие; далее они вступают в необратимые хим. и
электрохим. взаимод., заканчивающиеся образованием стабильных продуктов фотоэлектрохим.
р-ции. Частицы стабильных продуктов запасают в себе, по крайней мере, часть
первоначально поглощенной энергии света, другая часть расходуется (инактивируется)
в ходе обратных р-ций, рекомбинации и т. п., причем поглощенная энергия света
превращается в тепло.
В случае металлич. электрода
фотовозбуждение обусловлено переходом поглотивших квант света валентных электронов
на более высокие энергетич. уровни. Возбужденные электроны с энергией, превышающей
работу выхода из металла, и имеющие отличный от нуля импульс в направлении нормали
к пов-сти электрода могут покинуть металл и перейти в делокализованном состоянии
в р-р, образуя ток фотоэлектронной эмиссии (фототок). Фототок I зависит
от энергии кванта света hn(h - постоянная Планка, n - частота)
и потенциала электрода E по т. наз. закону пяти вторых:
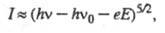
где hn0
- работа выхода электрона из металла в р-р при E = 0 (n0-пороговая
частота фотоэмиссии), е- заряд электрона. Квантовый выход фототока, равный
отношению числа электронов, перенесенных в электрохим. цепи, к числу падающих
на электрод фотонов, невелик, порядка 10-4; при обычно применяемой
освещенности электрода фототок составляет порядка 10-5 А/см2.
Попавшие в р-р электроны
сольватируются р-рителем; сольватир. электроны вступают в хим. реакции с компонентами
р-ра, восстанавливая их (напр., ион H+ - до атомарного водорода).
Продукты восстановления могут восстанавливаться далее либо окисляться обратно
на пов-сти электрода в ходе "темновых" (в отсутствие освещения)
электрохим. р-ций. Так, атомарный водород при положит. электродных потенциалах
окисляется до H+, а при отрицательных превращается в H2.
Измерение фототока лежит в основе методов исследования сольватир. электронов
и продуктов их хим. р-ций.
При фотовозбуждении полупроводника
электроны валентной зоны, поглотив квант света, переходят в зону проводимости,
оставляя в валентной зоне положительно заряженные дырки. Электроны проводимости
и дырки могут вступать в электрохим. р-ции, соотв. катодные и анодные, обусловливающие
фототек. Скорость р-ций и, следовательно, фототок увеличиваются с концентрацией
фотогенерир. электронов и дырок (см. Электрохимия полупроводников).
При поглощении квантов
света ионами и молекулами р-ра электролита последние переходят в возбужденное
состояние. Электродные потенциалы окислит.-восстановит. систем, в состав к-рых
входят возбужденные ионы или молекулы, не совпадают с потенциалами тех же систем
в невозбужденном состоянии. Поэтому при освещении могут протекать элект-рохим.
р-ции с участием возбужденных частиц, к-рые в невозбужденном состоянии тех же
частиц (как темновые процессы) не идут. Поскольку время жизни возбужденных состояний
невелико (обычно не более 1 мс), в электрохим. р-циях участвуют только частицы,
образованные в непосредственной близости к пов-сти электрода или адсорбированные
на этой пов-сти. Так, адсорбированные на пов-сти полупроводникового электрода
красители родамин Б, бенгальский розовый и др., поглощающие видимый свет и в
возбужденном состоянии окисляющиеся (т. е. отдающие электрон полупроводнику),
используются в качестве сенсибилизаторов, повышающих чувствительность широкозонных
полупроводников (TiO2, ZnO) к видимому свету.
Фотолиз р-ра при его освещении
приводит к образованию стабильных продуктов, в числе к-рых м. б. окислители
и восстановители, способные вступить в злектрохим. р-ции на электродах. В ячейке
с селективными электродами, один из к-рых избирательно чувствителен по отношению
к окислителю, а другой - к восстановителю, освещение р-ра генерирует ток во
внеш. цепи, при этом происходит преобразование световой энергии в электрическую.
Фотоэлектрохим. ячейку
характеризуют: кпд, равным отношению произведенной электрич. и(или) хим. энергии
к энергии падающего (иногда - поглощенного) света, фотоэдс разомкнутой цепи
и фототок короткого замыкания. Эти величины тем выше, чем большая доля первичных
возбужденных состояний, образовавшихся при поглощении квантов света, избегает
инактивации и вступает в полезные электрохим. р-ции. Напр., фотогальванич. ячейка,
чувствительная к свету с длиной волны 450-650 нм, основана на фотовозбуждении
р-ра, содержащего тиазиновый краситель тионин и Fe2+. Возбужденный
светом тионин окисляет Fe2+ до Fe3+, сам при этом восстанавливаясь.
Далее Fe3+ восстанавливается на одном из электродов ячейки, а восстановленная
форма тио-нина окисляется на другом, при этом в р-ре регенерируются исходные
в-ва. Такая электрохим. ячейка имеет кпд ок. 0,1%.
Фотоэлектрохим. р-ции используют
для травления полупроводниковых материалов. Поскольку скорость анодного травления
увеличивается с ростом интенсивности освещения, неравномерное освещение полупроводникового
анода позволяет вытравливать на его пов-сти заданный-рельеф. Напр., травлением
GdS, GaAs и др. в интерферирующих лазерных пучках получают дифракционную решетку
с разрешением до 6000 линий/мм.
Достижения Ф. позволяют
реализовать прямое преобразование солнечной энергии в хим. энергию продуктов
фотоэлек-трохим. р-ций и энергию электрич. тока. Фотоэлектрохим. элементы для
преобразования солнечной энергии делятся на элементы для фотоэлектролиза и элементы
для произ-ва электрич. энергии (т. наз. жидкостные солнечные батареи). Так,
для фотоэлектролиза воды служит ячейка с кислым электролитом и фотокатодом из
InP (полупроводник p-типа), на пов-сть к-рого нанесен микроосадок Pt
или Rh для повышения электрокаталитич. активности. При освещении на InP выделяется
H2; кпд преобразования солнечной энергии в химическую составляет
6-8%. Примеры "жидкостных солнечных батарей": элемент с фотоанодом
из GaAs n-типа и щелочным р-ром K2Se + K2Se2,
элемент с фотоанодом из CuInSe2 и р-ром KI+ KI3 + HI;
их кпд достигает 12-15%. Наиб. эффективные полупроводниковые фотоэлектроды изготавливают
из кремния, фосфида индия, арсенида галлия, теллурида и селенида кадмия.
Лит.: Гуревич ЮЛ.
[и др.], в кн.: Итога науки н техники, сер. Радиационная химия. Фотохимия, т.
1,М., 1978; Гуревич ЮЛ., Плесков Ю.В., Фотоаиектрохимия полупроводников, M.,
1983; Плесков Ю.В., Фотоэлект-рохимическое преобразование солнечной энергии,
M., 1990. Ю.В. Плесков.


