ХЛОРУКСУСНЫЕ КИСЛОТЫ.
Различают
моно-(С1СН2СООН), ди- (С12СНСООН) и трихлоруксусные
к-ты (С13ССООН). Монохлоруксусная к-та - бесцв. гигроскопич.
кристаллы; существует в 4 кристаллич.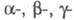 и
и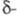 формах. Наиб.
устойчива
формах. Наиб.
устойчива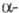 форма,
имеющая моноклинную кристаллич. решетку; параметры решетки: а =
0,538, b=1,927, с = 0,801 нм,
форма,
имеющая моноклинную кристаллич. решетку; параметры решетки: а =
0,538, b=1,927, с = 0,801 нм,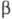 =
109,5°, z = 8, пространств, группа Р 21/с.
Дихлоруксусная
к-та - бесцв. жидкость; трихлоруксусная -бесцв. гигроскопич. кристаллы,
существует в двух кристаллич. формах:
=
109,5°, z = 8, пространств, группа Р 21/с.
Дихлоруксусная
к-та - бесцв. жидкость; трихлоруксусная -бесцв. гигроскопич. кристаллы,
существует в двух кристаллич. формах: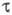 и
и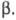 Свойства
X. к. см. в табл. 1.
Свойства
X. к. см. в табл. 1.
Табл. 1. - СВОЙСТВА ХЛОРУКСУСНЫХ
КИСЛОТ
|
Показатель
|
ClCH2COOH
|
Cl2CHCOOH
|
Cl3CHCOOH
|
|
Мол. м.
|
94,5
|
128,9
|
163,4
|
|
Т.пл.,
oС
|
62,3*
|
13,5
|
57,4**
|
|
Т. кип., °С
|
187,85
|
194
|
197,6
|
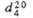 |
1,403440
|
1,563420
|
1,6225
|
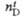 |
1,435155
|
1,465820
|
1,460361
|
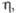 мПа x с
мПа x с |
1,29 (100 °C)
|
4,78 (35 °C)
|
3,03 (70 °C)
|
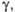 мН/м
мН/м |
35,17 (100 °С)
|
38,6 (20 °C)
|
28,54 (80 °С)
|
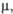 Кл-м
Кл-м |
0,68 x 10-30
|
_
|
0,67 x 1 0-30
|
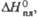 кДж/моль
кДж/моль |
19,37
|
7,67
|
5,88
|
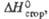 кДж/моль
кДж/моль |
—
|
-621
|
-491
|
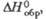 кДж/моль
кДж/моль |
-490,1 (100 oС)
|
-502,9
|
—
|
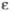 |
12,3 (60 °С)
|
8,2 (22 °С)
|
4,6 (60 oC)
|
|
ка
|
1,4 x 10-3
|
5,1 x 10-2
|
2,2 x 10-1
|
|
Т. вел., oС
|
132
|
110
|
—
|
|
Т. самовоспл.,
°С
|
446
|
660
|
711
|
|
ЛД50,
мг/кг (крысы, пер-орально)
|
76
|
2820
|
5000
|
|
ПДК***, мг/м3
|
1
|
4
|
5
|
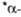 Форма.
Форма.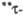 Форма.
***В воздухе рабочей зоны.
Форма.
***В воздухе рабочей зоны.
Х. к. раств. в воде (для С1СН2СООН
- 604 г в 100 г воды при 30 С), ацетоне, бензоле, ССl4, СН2С12,
CS2 и др.
X. к.- типичные представители
галогенкарбоновых
кислот. Монохлоруксусная к-та легко вступает в р-ции нуклеоф. замещения
по атому С1. При обработке горячим спиртовым р-ром C2H5ONa
образуется этоксиуксусная к-та, с щелочным р-ром фенола - феноксиуксусная
к-та, с цианидами щелочных металлов - циануксусная кислота, с этилендиамином
-этилендиаминтетрауксусная кислота (ЭДТА), с гидроксидами щелочных
металлов - гликолевая кислота, с водным р-ром гидросульфида калия
- тиогликолевая кислота. Р-ция С1СН2СООН с анилином -
пром. метод получения индиго, р-цией с NH3 получают глицин,
с
метиламином - саркозин CH3NHCH2COONa, с щелочной
целлюлозой - карбоксиметилцеллюлозу.
X. к. реагируют по карбоксильной группе
с образованием сложных эфиров (хлорацетатов), ангидридов, галогенангидридов,
амидов, нитрилов (табл. 2). Так, при взаимод. С1СН2СООН с РС13
при 100 °С образуется хлорацетилхлорид - полупродукт в синтезе лек. в-в
(хлозепид, сибазон и др.), р-ция С1СН2СООН со спиртами в присут.
к-т приводит к сложным эфирам, обладающим фунгицидным действием. При взаимод.
хлорангидридов X. к. с NH3 образуются амиды.
Табл. 2. - СВОЙСТВА НЕКОТОРЫХ
ПРОИЗВОДНЫХ ХЛОРУКСУСНЫХ КИСЛОТ
|
Соединение
|
Мол. м.
|
Т. пл., oС
|
Т. кип., °С
|
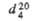 |
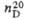 |
|
Этилхлорацетат
ClCH2COOC
2H5 |
122,55
|
-26
|
144,2
|
1,4227
|
1,1585
|
|
Хлорацетилхлорид
ClCH2COCl
|
112,94
|
-21,7
|
105
|
1,4177
|
1,4535
|
|
Дихлорацетилхлорид
С12СНСОС1
|
147,38
|
—
|
107,3
|
1,5315
|
1,4591
|
|
Дихлорацетамид
Сl2СНСОNH2
|
127,95
|
96
|
233
|
—
|
—
|
|
Трихлорацетил
хлорид Сl3ССОС1
|
181,83
|
-56,9
|
118,5
|
1,6202
|
1,4697
|
|
Трихлорацетамид
Cl3CCONH2
|
162,40
|
142
|
238
|
—
|
—
|
Трихлоруксусная к-та легко декарбоксилируется:
при кипячении в 1,2-диметоксиэтане образуется дихлоркарбен, при нагр. с
щелочами или аминами - хлороформ. Нейтрализация трихлоруксусной к-ты водным
р-ром NaOH или Na2CO3 приводит к трихлорацетату натрия
- гербициду широкого спектра действия.
Осн. пром. методы получения С1СН2СООН
- хлорирование уксусной к-ты в присут. катализаторов (Р, S, уксусный ангидрид)
при 100-150 °С и кислотная гидратация 1,1,2-трихлорэтилена 90-93%-ной H2SO4
при 160-180 °С. Она м. б. получена также гидрированием С12СНСООН
или С13ССООН в водной среде в присут. Pd либо электрохим. восстановлением
в присут. Fe3O4; хлорированием кетена; из СН3СООН
и SOC12 при 115-120 °С и 0,4-0,5 МПа.
Для получения С12СНСООН используют
р-цию хлоральгидрата с СаСО3 и NaCN с послед. подкислением;
хлорирование СН3СООН и С1СН2СООН; окисление дихлорацетальдегида
HNO3; гидролиз дихлорацетилхлорида и др. методы.
В пром-сти С13ССООН получают
окислением хлораля 42%-ной HNO3 при 60-65 °С. Другие методы:
прямое хлорирование СН3СООН, С1СН2СООН, С12СНСООН
или их смесей в присут. катализатора или при УФ облучении; гидролиз трихлорацетилхлорида;
гидролитич. окисление тетрахлорэтилена; кипячение хлораля с р-ром Са(С1О)2.
X. к.- важные полупродукты орг. синтеза.
Наиб. широко применяют С1СН2СООН: в синтезе красителей, лек.
в-в, витаминов, пестицидов (напр., 2,4-Д, 2М-4Х; см. Гербициды);
С12СНСООН
и ее производные используют в произ-ве косметич. и лек. в-в; сама С12СНСООН
обладает высокой антивирусной и противогрибковой активностью; С13ССООН
применяют в биохимии, медицине (антисептич., вяжущее средство).
Лит.: Kirk-Othmer encyclopedia, 3 ed., v. 1, N.Y., 1978, p. 171-74; Общая органическая химия, пер. с англ., т. 4, М., 1983; Мельников Н. Н., Пестициды. Химия, технология и применение, М., 1987.
С. К. Смирнов, С. С. Смирнов.


